Những căn bệnh truyền nhiễm thường gặp và nguy hiểm nhất trên đàn gia cầm hướng trứng chính là các bệnh trên hệ thống hô hấp. Chúng thường được chia làm hai loại: bệnh do vi khuẩn gây ra như Mycoplasma gallisepticum (MG) và bệnh Coryza(Avibacterium paragallinarum), và bệnh do vi-rút gây ra như bệnh Newcastle (Newcastle Disease: ND), Viêm Phế-quản Truyền nhiễm (Infectious Bronchitis: IB), Viêm Thanh-khí-quản Truyền nhiễm (Infectious Laryngotracheitis: LT), Cúm Gia cầm (Avian Influenza: AI) và Viêm đường Hô-hấp-trên Gia cầm (Avian Metapneumovirus).
Mỗi bệnh đều có đặc điểm riêng, phụ thuộc vào bản chất của vi sinh vật gây bệnh, loài gia cầm bị nhiễm, con đường truyền lây, và phương pháp kiểm soát / biện pháp tiêm phòng đang được áp dụng trong trại.
Các bệnh hô hấp thường gây ra dấu hiệu lâm sàng khá giống nhau, vì thế, sẽ gây khó khăn trong việc phân biệt từng bệnh nếu chỉ dựa vào triệu chứng và bệnh tích. Do đó, nên có biện pháp phù hợp để chuẩn đoán và giúp nhận biết rõ dấu hiệu đặc trưng của mỗi loại bệnh.
Trên thật tế, triệu chứng lâm sàng của các bệnh hô hấp ít khi nào chỉ có một nguyên nhân gây bệnh duy nhất. Chúng thường là sự kết hợp của nhiều bệnh cùng xảy ra trong đàn, vì thế có thể làm cho tình trạng của đàn tồi tệ hơn và gây khó khăn trong việc chuẩn đoán chính xác nguyên nhân gây bệnh. Thông thường, một trong những bệnh do vi khuẩn gây ra (MG hay Coryza) có thể đã hiện diện sẵn trong đàn bị nhiễm bệnh mãn tính, và sau đó tình trạng đàn này sẽ nặng hơn khi có một vi-rút gây bệnh khác xâm nhập vào (như vi-rút gây bệnh IB hay ND). Tác động kết hợp của cả loại này sẽ làm dấu hiệu bệnh xuất hiện trầm trọng hơn và kéo dài hơn khi so với chỉ có một nguyên nhân gây bệnh. Trường hợp này thường được gọi là Bệnh Hô hấp Mãn tính (Chronic Respiratory Disease: CRD).
Dấu hiệu lâm sàng của các bệnh trên đường hô hấp rất dễ quan sát. Điều trị tất cả các bệnh này bằng kháng sinh phổ rộng vẫn còn hiệu quả. Tuy nhiên, để có được một sự kiểm soát tối ưu, người chăn nuôi cần phải áp dụng đúng phương pháp chuẩn đoán để xác định chính xác nguyên nhân gây bệnh và thiết kế được một chiến lược kiểm soát phù hợp cho từng loại bệnh có thể xảy ra trong trại.
Kiểm tra mổ khám, mô bệnh học, nuôi cấy và xác định vi khuẩn, huyết thanh học và các phương pháp sinh học phân tử (PCR) có thể rất hữu dụng trong việc nhận dạng các bệnh khác nhau trên đường hô hấp.

Hình 1: Mỗi bệnh phải có một quy trình chuẩn đoán thích hợp để xác định chính xác vấn đề đang xảy ra nhằm tập trung giải quyết nguyên nhân chính
Kiểm tra mổ khám có thể được dùng để chuẩn đoán một số bệnh, như ký sinh trùng hay viêm ruột, nhưng hầu hết các bệnh trên đường hô hấp sau khi mổ khám lại cho kết quả tương tự nhau. Vì thế, để phân biệt các bệnh này, cần thực hiện thêm một số phương pháp chuẩn đoán khác. Ví dụ như, mẫu mô cố định formalin có thể cho biết bệnh tích trên tế bào, do đó có thể giúp chuẩn đoán được bệnh Đậu Gà (dạng khô hoặc ướt) và bệnh LT.
Đậu khô trên khí quản có thể xuất hiện các dấu hiệu tương tự với LT, nên mô bệnh học là phương pháp nên thực hiện khi đàn gia cầm bị nghi ngờ mắc phải một trong hai bệnh này. Ngoài ra, mô bệnh học chỉ có thể giúp biết được các dấu hiệu bệnh tích chung của các bệnh hô hấp, mà không thể chuẩn đoán phân biệt cụ thể đó là bệnh gì.
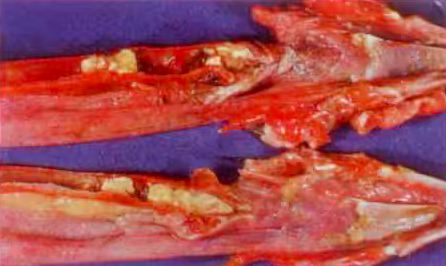
Hình 2: Viêm khí quản nghiêm trọng – là LT hay Đậu Gà?
QUY TRÌNH CHUẨN ĐOÁN
Phân lập và xác định vi sinh vật gây bệnh là phương pháp chuẩn đoán chính xác nhất, nhưng đây lại là phương pháp không thật tế. Một số vi khuẩn gây bệnh tương đối dễ nuôi cấy trong phòng thí nghiệm, như E. coli, hay Salmonella, nhưng MG và Coryza – hai bệnh hô hấp do vi khuẩn gây ra lại cần môi trường nuôi cấy và điều kiện phân lập đặc biệt.
Vi-rút cũng tương đối khó phân lập và xác định vì chúng cần các tế bào sống để nhân lên, như trứng gà chứa phôi hay tổ chức tế bào mô. Vì mục tiêu chuẩn đoán, các phương pháp phân tích sinh học mới hơn như PCR đã được sử dụng thay thế nhằm định danh một số vi sinh vật gây bệnh khó nuôi cấy này.
PCR xác định sự hiện diện của gien hay đoạn DNA đặc trưng của vi sinh vật. Đây là phương pháp rất nhạy và chuyên biệt, vì thế, có giá trị tương đương với phương pháp phân lập và xác định vi sinh vật. Bộ kít PCR đang bán ngoài thị trường đã tích hợp một số chuẩn đoán trong phòng thí nghiệm theo hướng thuận tiện sử dụng trong thật tế.
Nên xây dựng một chương trình an toàn sinh học thích hợp trong trại để giúp ngăn ngừa các tác nhân đang trở thành mầm mồng nhiễm bệnh, cũng như các tác nhân gây bệnh mới có khả năng xảy ra. Phải xem xét đặc điểm đặc trưng của các bệnh này như nguồn lây lan bệnh đang hiện diện trong trại, phương thức lan truyền bệnh và những vật thể sống trong môi trường.
Các nguy cơ an toàn sinh học thường gặp có thể đến từ các động vật khác đang sống trong trại (động vật nuôi hay hoang dã), con người đã tiếp xúc với các gia cầm khác, không khí bị nhiễm mầm bệnh từ các trại khác hay nhà cửa xung quanh, dụng cụ sử dụng ở trại khác, đàn mới đang được chuyển vào trại, và các mặt hàng thiết thực khác như nước và thức ăn.
Người quản lý trại cần phải cân nhắc các nguy cơ có thể phá hủy quy trình an toàn sinh học và nên thiết kế một chương trình thích hợp để tất cả nhân viên trong trại và khách tham quan phải tuân theo.
Đối với bệnh đang tồn tại trong trại, nên thiết kế một chương trình tiêm phòng hợp lý với các vắc-xin sống và bất hoạt thích hợp nhằm cung cấp sự miễn dịch cần thiết mà không gây áp lực quá mức cho đàn gia cầm đang nuôi.
Khi thiết kế chương trình tiêm phòng, cần lưu ý đến bệnh đang hoành hành trong trại, mức độ kháng thể mẹ truyền trong gà con, vắc-xin nào còn sử dụng được, dùng vắc-xin sống hay bất hoạt và nên sử dụng phương pháp phun sương hay pha với nước.
Một số vắc-xin phòng bệnh hô hấp chỉ có công hiệu khi ở dạng vắc-xin sống (như LT), một số khác lại ở dạng bất hoạt (như Coryza), nhưng hầu hết các trường hợp còn lại, cả hai dạng đều cho kết quả như nhau. Trong vài trường hợp, chúng ta chỉ cần sử dụng một dạng, hoặc là sống hoặc là bất hoạt, như MG. Nhưng cũng có trường hợp (như ND và IB), chúng ta thường sử dụng vắc-xin sống trước để kích thích sự bảo vệ đầu tiên và để “làm mồi” cho hệ thống miễn dịch hoạt động chống lại kháng nguyên đó. Sau đó, chúng ta tiếp tục tái chủng với vắc-xin bất hoạt, tiêm thẳng vào gà hậu bị để có sự bảo vệ kéo dài hơn với mức kháng thể chuẩn cao hơn.
Thiết kế chương trình tiêm phòng chỉ là bước đầu tiên; kỹ thuật tiêm phòng sau đó mới là bước quan trọng để quyết định khả năng miễn dịch đồng đều của tất cả gà trong đàn.
Phương pháp tốt nhất để chủng ngừa vắc-xin sống trong việc phòng bệnh hô hấp chính là phương pháp nhỏ mắt. Nhưng các phương pháp chủng ngừa hàng loạt khác (phun sương hoặc pha nước uống) thường được áp dụng để tiết kiệm nhân công. Nhược điểm của phương pháp chủng ngừa hàng loạt này trong đàn gia cầm có quy mô lớn là không đảm bảo được sự đồng đều vắc-xin trên tất cả gà trong đàn.
Đối với phương pháp pha nước uống, tốt nhất nên sử dụng khi gà đang khát vì lúc này chúng sẽ tiêu thụ hết nước có pha vắc-xin trong vòng 1 đến 2 giờ; và nên thực hiện vào sáng sớm (khi ánh sáng mặt trời vừa mới xuất hiện). Vì hầu hết vi-rút gây bệnh hô hấp trong các vắc-xin sống sẽ chết đột ngột và bị bất hoạt sau hai giờ tồn tại ở môi trường ngoài. Một điều quan trọng khác cần phải lưu ý chính là số lượng nước dùng để pha vắc-xin. Số lượng này phải vừa đủ để tất cả các gà trong trại tiêu thụ, nhưng không quá nhiều đến mức còn thừa lại và sẽ tồn đọng trong hệ thống cung cấp nước và bị bất hoạt. Chính vì thế, người chăn nuôi phải lập kế hoạch cẩn thận và nên thực hiện thử vài lần trước khi tiến hành chủng ngừa thật sự.
Phương pháp phun sương dễ dàng thực hiện hơn, nhưng cũng phải cân nhắc đến khối lượng nước cần thiết được sử dụng để vắc-xin phân bố đồng đều đến tất cả gà trong trang trại. Trong một số vắc-xin vi-rút như LT, khi vắc-xin không được phân bố đều sẽ làm kết quả tiêm chủng giữa các gà trong trại khác nhau và có thể xuất hiện trường hợp: vi-rút trong vắc-xin khôi phục yếu tố độc lực; và khi đó, việc “nổ dịch” LT hoàn toàn có thể xảy ra và nguyên nhân cho ổ dịch này chính là kỹ thuật chủng ngừa trong trại.
Một điều cần lưu ý: tất cả vắc-xin sống đều rất dễ trở nên bất hoạt bởi các hóa chất dùng trong khâu xử lý nước vẫn còn tồn tại trong nước. Do đó, nên sử dụng thêm chất giúp ổn định vắc-xin như các sản phẩm có nguồn gốc từ sữa hay các sản phẩm mới hơn có tác dụng trung hòa mọi chất chlorine còn hiện diện trong nước.
Sau khi chủng ngừa, xét nghiệm huyết thanh học sẽ giúp kiểm tra tình trạng miễn dịch trong đàn và xác định khu vực thực hiện quy trình chủng ngừa kém. Nên nhớ, kháng thể thường cần 2 đến 4 tuần sau khi chủng ngừa để hình thành và phát triển, và mẫu máu nên được thu thập từ một số gà đại diện trong đàn.
Khi đã có mẫu, nên tiến hành phân tách huyết thanh và bảo quản lạnh để vận chuyển đến phòng thí nghiệm. Kỹ thuật phòng thí nghiệm thường áp dụng, bao gồm phản ứng ngưng kết nhanh trên phiến kính hay ELISA dùng cho MG và ELISA cho ND, IB và có thể dùng cho cả LT, AI và pneumovirus.
Thông thường, đàn đã được chủng ngừa sẽ phát hiện được kháng thể; nhưng vẫn có một số vắc-xin không thể kích thích được hệ thống miễn dịch để tạo kháng thể. Vì thế, nên tiến hành đánh giá kết quả huyết thanh học với chương trình chủng ngừa để xác định tính hiệu quả của vắc-xin. Các độ chuẩn trong huyết thanh học không những giúp xác định đó có phải là mức kháng thể thích hợp khi tiến hành chủng ngừa hay không, mà còn biết sự đồng đều trong đáp ứng miễn dịch giữa các cá thể trong đàn.

Hình 3 Dupont BAX Salmonella PCR
Khi kết quả là dương tính với kháng thể của một bệnh, có hai trường hợp xảy ra: đàn đã được chủng ngừa hoặc đàn đã tiếp xúc với vi-rút gây bệnh ngoài môi trường (nếu trước đó chưa được chủng ngừa). Vì thế, huyết thanh học chỉ có thể xác nhận sự tồn tại của bệnh, không xác định được nguồn gốc của bệnh. Do đó, các kỹ thuật chuẩn đoán khác cũng phải thực hiện đồng thời để xác định chính xác vấn đề đang tồn tại trong trại.
VẮC-XIN VÉC-TƠ
Một số vắc-xin véc-tơ thế hệ mới đã xuất hiện, có khả năng cung cấp sự miễn dịch mà không làm tổn thương đường hô hấp như các vắc-xin thông thường. Các vắc-xin véc-tơ được cấp phép gần đây đều là các vắc-xin sử dụng “vi-rút mang” (carrier) của một trong hai bệnh: vi-rút thường được dùng để sản xuất vắc-xin phòng ngừa FP hoặc sản xuất vắc-xin HVT phòng bệnh Marek.
Các vi-rút này được biến đổi để mang theo một số gien quan trọng của các vi-rút gây bệnh khác nhằm tạo ra các protein miễn dịch chống lại tất cả các bệnh này. Vì thế, khi vi-rút Đậu hay HVT đã biến đổi này nhân lên trong cơ thể thì protein ngoại lai được cấy thêm cũng được nhân lên và kích thích hệ thống miễn dịch chống lại chúng mà không gây ra phản ứng phụ như khi tiêm vắc-xin chứa toàn bộ vi-rút gây bệnh.
Véc-tơ Đậu thường được cấy thêm gien của vi-rút gây bệnh LT, ND, AI và MG. Véc-tơ HVT thì được sử dụng cho bệnh LT, IBD và ND.
Véc-tơ không được xảy ra phản ứng đào thải với gien ngoại lai được cấy vào, và một điều quan trọng chính là: không những phải kích thích hệ thống miễn dịch chống lại vi-rút véc-tơ mà còn tạo ra đầy đủ kháng thể chống lại các gien của vi-rút ngoại lai được thêm vào.
Vì lý do này, trước khi sử dụng vắc-xin véc-tơ, người chăn nuôi không được sử dụng các vắc-xin phòng bệnh của các vi-rút làm véc-tơ. Ví dụ như, véc-tơ Đậu được sử dụng vào thời điểm 8 – 12 tuần tuổi thì đàn đó không nên tiến hành chủng ngừa với vắc-xin Đậu ở trại ấp hay bất kì thời điểm nào trước khi chủng ngừa vắc-xin véc-tơ. Tương tự như vậy, sản phẩm véc-tơ HVT cũng không nên sử dụng cùng với các vắc-xin thông thường phòng chống HVT hay các vắc-xin véc-tơ HVT khác.
Có lẽ trong tương lai chúng ta sẽ có nhiều loại vắc-xin véc-tơ khác có khả năng mang theo protein ngoại lai, nhưng hiện tại, chúng ta chỉ có thể lựa chọn giữa một vắc-xin véc-tơ HVT duy nhất và một vắc-xin véc-tơ Đậu duy nhất trong số những sản phẩm đang có mặt ở thị trường.
Quy trình kiểm soát bệnh hô hấp cần rất nhiều công sức để thực hiện, nhưng mục đích cuối cùng vẫn là duy trì được sức khỏe của đàn và khả năng sản xuất của đàn gia cầm hướng trứng trên khắp thế giới.
Bài báo này được đăng trên tạp chí “International Poultry Production” ©Copyright 2012, All Rights Reserved.
Nguồn tin: Ceva Việt Nam
- Tác động của thức ăn côn trùng và vi tảo đến chất lượng thịt gà
- Công nghệ phức hợp miễn dịch và tái tổ hợp trong nhà máy ấp
- 5 yếu tố cần xem xét trong một chương trình chăn nuôi heo không kháng sinh
- Bệnh bại liệt ở chó
- Biến động chất lượng vỏ trứng trong suốt chu kỳ đẻ trứng của gà
- Cải thiện hoạt động sản xuất thịt gia cầm không kháng sinh
- Đặc điểm sinh sản giống chó H’Mông cộc đuôi
- Lựa chọn đúng nguồn canxi cho loại thức ăn phù hợp
- Vịt to xác đẹp mã nhưng nhẹ cân
- Các dấu hiệu của bệnh cúm chó và cách điều trị
Tin mới nhất
CN,22/02/2026
- TP. Hồ Chí Minh: Tăng cường phòng chống dịch bệnh trên đàn vật nuôi dịp Tết Nguyên đán Bính Ngọ năm 2026
- Đón đọc Tạp chí Chăn nuôi Việt Nam số tháng 02 năm 2026
- Cấp bách phòng, chống dịch cúm gia cầm ở Hà Tĩnh
- Thái Nguyên: Lan tỏa mô hình ‘Ngân hàng gà đen’ ở Phong Quang
- Dịch tả lợn châu Phi bùng phát tại Hàn Quốc
- Giải pháp toàn diện cho dây chuyền sản xuất thức ăn thú cưng
- Vắc-xin AVAC ASF LIVE
- Kiểm soát bệnh đường ruột
- Khai thác sức mạnh từ thực vật
- Tập đoàn Hoàng Gia De Heus
- AChaupharm: Nấm phổi gia cầm, hiểm họa thầm lặng khi giao mùa
- Chuyên gia bàn giải pháp sử dụng kháng sinh có kiểm soát trong chăn nuôi
- Ngành sữa Việt Nam: Cơ hội “bứt phá” từ nội lực
- Dịch tả heo châu Phi: Hiện trạng và giải pháp kiểm soát hiệu quả (Phần 1)
- Bộ NN&MT mở đợt ‘truy quét’ việc lạm dụng chất kích tăng trưởng, tăng trọng
- Cargill rút khỏi ngành thức ăn thủy sản tại Việt Nam, đóng cửa nhà máy tại Đồng Tháp và Long An
- Chăn nuôi dê bền vững theo chuỗi giá trị: Chủ nhà hàng là mắt xích quan trọng
- Da khỏe, lông đẹp: Chiến lược dinh dưỡng hiệu quả cho heo con sau cai sữa
- Lo ngại bệnh than, Campuchia ngừng nhập một số sản phẩm từ Thái Lan
- Cạn tiền, một công ty tại Nam Phi phải tiêu hủy hơn 350.000 con gà

























































































 đã long trọng tổ chức Hội nghị tổng kết và tri ân khách hàng với chủ đề “Đồng hành dẫn lối tương lai”. Nhân dịp này, Ban Giám đốc công ty đã […]/0.jpg)











Bình luận mới nhất