TÓM TẮT
Bệnh Marek là bệnh truyền nhiễm gây tổn thất lớn trong chăn nuôi gà. Bệnh gây ra bởi Gallid herpesvirus. Trong tự nhiên, bệnh chủ yếu được truyền lây qua đường hô hấp, gà cảm nhiễm có thể mắc bệnh do hít phải virus gây bệnh trong tế bào nang lông hoặc mãnh biểu mô da của gà nhiễm virus.
Với mục đích khảo sát sự lưu hành của virus gây bệnh (MDV-Marek’s disease virus) trên giống gà thả vườn, nghiên cứu này được thực hiện qua việc phát hiện gen Meq của MDV từ 132 mẫu nang lông của 132 đàn gà thu thập từ 105 hộ chăn nuôi tại 5 huyện Hồng Ngự, Cao Lãnh, Lấp hiện gen Meq đặc hiệu của 3 serotype (1, 2 và 3) của Gallid herpesvirus. Kết quả nghiên cứu cho thấy đã phát hiện 36/132 đàn có nhiễm MDV serotype 1 với tỷ lệ 27,27%, huyện có tỷ lệ đàn gà nhiễm cao nhất là Lấp Vò 64% (16/25), kế đến là Châu Thành 32,14% (9/28), Lai Vung 23,53% (8/34), Cao Lãnh 11,11% (3/27) và 0,0% (0/18) ở huyện Hồng Ngự, chưa phát hiện được MDV serotype 2 và 3 (HVT-Herpes virus of turkey).
Từ khóa: Bệnh Marek, bản địa, Đồng Tháp, gà, serotype.
ABSTRACT
Circulating of Marek’s disease virus in indigenous chickens in Dong Thap province Marek disease is an infectious disease caused by Gallid herpesvirus. In nature, the disease is mainly transmitted by the airborne route, sensitive chickens can be sick by inhaling infectious virions in the skin particles and feather debris of carrier chickens.
With the aim to survey the prevalence of MDV (Marek disease virus) in backyard chickens, this study was carried out by detecting Meq gene from 132 samples of chicken feather follicles collected from 132 chicken flocks of 105 households in 5 districts including Hong Ngu, Cao Lanh, Lap Vo, Lai Vung, Chau Thanh of Dong Thap province. Realtime PCR was used to detect specific Meq gene of 3 serotypes (1, 2 and 3) of Gallid herpesvirus. The results showed that 36 out of 132 flocks were infected by MDV serotype 1 comprising 27,27%; the highest prevalence was reported in Lap Vo 64.0% (16/25), followed by Chau Thanh 32.14% (9/28), Lai Vung 23.53% (8/34), Cao Lanh 11.11% (3/27), and none infected flock was reported in Hong Ngu district (0/18), MDV serotype 2 and serotype 3 (HVT-Herpes virus of turkey) was not detected.
Keywords: Marek’s disease, indigenous. Dong Thap, serotype.
1. ĐẶT VẤN ĐỀ
Bệnh Marek là một bệnh ác tính truyền nhiễm nguy hiểm ở gà do Gallid Herpesvirus 2 gây ra. Virus trưởng thành có khả năng gây nhiễm khu trú ở tế bào biểu mô nang lông và lây truyền chủ yếu qua đường hô hấp. Bệnh gây thiệt hại lớn cho ngành chăn nuôi gà do tỷ lệ bệnh và tỷ lệ chết cao, có khi lên tới 25-30%, đặc biệt có đàn đến 60%, bệnh cũng gây suy giảm miễn dịch, ảnh hưởng chấtlượng đàn gà giống và giảm chất lượng thịt (Lê Văn Năm, 2003; Couteaudier và Denesvre, 2014).
Do bệnh không thể điều trị được bằng kháng sinh, nên việc tiêm phòng vaccine và an toàn sinh học được đặt lên hàng đầu. Tuy nhiên, hiện nay bệnh vẫn là mối nguy hiểm lớn trong chăn nuôi gà ở trên thế giới. Ở Việt Nam, trong năm 2007, bệnh Marek đã xảy ra trên gà ở 2 tỉnh Long An và Tiền Giang làm chết gần 40 ngàn con gà; mặc dù số gà này đã được tiêm phòng Marek nhưng bệnh vẫn xuất hiện (Hải Phương, 2007). Việc thất bại trong công tác phòng bệnh có thể là do nhiều lý do trong đó điều đáng quan tâm nhất là khác nhau giữa chủng vaccine và chủng gây bệnh đang lưu hành và sự mang trùng dai dẳng ở các đàn gà nhiễm virus.
Ở Đồng Tháp, trong những năm gần đây, nhiều gà bệnh chết có những dấu hiệu nghi ngờ bệnh Marek đã được ghi nhận, đặc biệt là ở gà bản địa do những người chăn nuôi chưa quan tâm đúng mức việc tiêm phòng và các biện pháp an toàn sinh học. Xuất phát từ thực tế trên, nghiên cứu này được hiện nhằm khảo sát sự mang trùng virus và xác định serotype của virus gây bệnh Marek hiện đang lưu hành trên đàn gà bản địa tại của địa phương.
2. VẬT LIỆU VÀ PHƯƠNG PHÁP
2.1. Vật liệu thiết bị
Ống tiêm, kéo, kẹp, bông gòn, cồn, ống đựng máu, ống eppendorf, tube PCR 0,2ml, khẩu trang, găng tay, đầu típ tương ứng với micropipette, waterbath (Memmert, Đức),máy ly tâm, máy Realtime PCR Mx3005p (Agilent, Mỹ),… Hóa chất và sinh phẩm: SDS (sodium dodecyl sulfate), Tris-HCL, cồn tuyệt đối, cồn 95o, EDTA, protease K, Taq Polymerase (Bioline, Anh Quốc), buffer (đệm + dNTP +MgCl2) của hãng Bioline; các primer đặc hiệu để phát hiện gene của MDV serotype 1, 2 và 3 (Công ty Sinh Hóa Phù Sa, Việt Nam).
2.2. Phương pháp
Nghiên cứu được thực hiện qua việc điều tra cắt ngang nhằm phát hiện virus Marek từ mẫu nang lông của gà thả vườn tại 5 huyện gồm Cao Lãnh, Châu Thành, Hồng Ngự Lai Vung và Lấp Vò của tỉnh Đồng Tháp. Trong nghiên cứu này, với mục đích xác định đàn nhiễm và các serotype của virus hiện lưu hành trên đàn gà địa phương, chúng tôi lấy mẫu theo đơn vị là đàn.
Tổng cộng có 132 đàn gà giống thả vườn có biểu hiện lâm sàng khỏe mạnh của 105 hộ chăn nuôi được chọn để lấy mẫu. Mỗi mẫu gộp từ mỗi đàn được thu thập bằng cách nhổ lấy lông 14 gà (1-2 lông/con), phần mẫu dùng xét ngiệm là đoạn gốc chân lông có kích thước 2-3cm, mỗi mẫu gộp của từng đàn cho được cho vào týp nhựa vô trùng, dãn nhãn ghi chú và lưu mẫu ở -20oC cho đến khi xét nghiệm. Phương pháp Realtime PCR được sử dụng để phát hiện MDV và xác định các serotype 1, 2 và 3; phương pháp chiết tách DNA được thực hiện theo Handberg và ctv (2001); trình tự các cặp mồi dùng để xác định các serotype của virus Marek được thực hiện theo nghiên cứu của López-Osorio và ctv (2017).
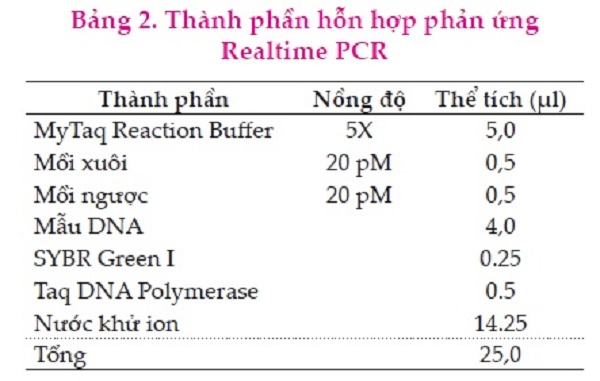
Thành phần của phản ứng sử dụng trong realtime PCR để xác định các serotype của virus Marek được thể hiện ở Bảng 2.
Chu trình nhiệt của phản ứng Realtime PCR gồm: tiền biến tính 950C trong 5 phút, sau đó 40 chu kỳ (biến tính 950C trong 20 giây, gắn mồi 600C trong 30 giây và kéo dài 60 độ C trong 30 giây), đọc tính hiệu huỳnh quang ở cuối giai đoạn này. Sau khi kết thúc 40 chu kỳ tiến hành chạy Melting curve (phân tích đường cong nóng chảy) nhằm kiểm tra sản phẩm đặc hiệu tránh dương tính giả, chu trình nhiệt như sau: 60 độ C trong 30 giây sau đó nâng dần nhiệt độ sau mỗi giây cho đến khi đạt 95 độ C trong 30 giây thì kết thúc phản ứng (đọc tính hiệu huỳnh quang mỗi giây trong suốt chu trình nhiệt).
Số liệu được xử lý theo phương pháp χ2, phần mềm Minitab 6.0 (Ryan và ctv, 2000).
3. KẾT QUẢ VÀ THẢO LUẬN
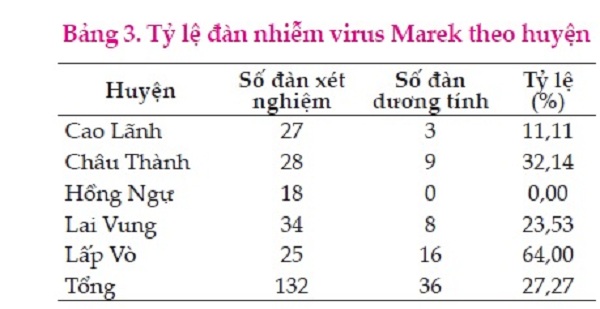
Qua kết quả Bảng 3 cho thấy trong tổng số 132 đàn được khảo sát có 36 đàn dương tính, chiếm tỷ lệ 27,27%. Nếu tính số tỷ lệ số hộ có đàn gà dương tính theo từng địa phương thì cao nhất là huyện Lấp Vò với 64,00% kế đến là huyện Châu Thành 32,14%, huyện Lai Vung với 23,53%, huyện Cao Lãnh với 11,11%, không ghi nhận đàn nhiễm ở huyện Hồng Ngự. Khi so sánh tỷ lệ giữa các huyện với nhau thì sự sai khác có ý nghĩa thống kê (P<0,00). Tỷ lệ lưu hành bệnh khác nhau có thể là do nhiều yếu tố như con giống, tiêm phòng, quy mô chăn nuôi, điều kiện địa lý,…
Tỷ lệ đàn gà nhiễm ở huyện Lấp Vò cao nhất có thể là do quy mô chăn nuôi cao hơn các địa phương khác (từ 70 con/hộ). Ngoài ra, về vị trí địa lý Lấp Vò là địa phương nằm trên các tuyến đường thủy, bộ đông đúc (nằm giáp giữa sông Tiền và sông Hậu, giáp giữa 2 tỉnh là An Giang và Cần Thơ) sự mua bán vận chuyển gia cầm liên tỉnh qua địa bàn huyện có thể là nguyên nhân làm gia tăng tỷ lệ nhiễm.
Ở địa bàn huyện Hồng Ngự do quy mô chăn nuôi nhỏ lẻ các hộ chăn nuôi chỉ nuôi dưới 50 con/hộ và khoảng cách giữa các hộ chăn nuôi khá xa, chủ yếu là giống Gà ta và gà Nòi. Đây có thể là nguyên do hạn chế được sự nhiễm bệnh của đàn gà với MDV, nên chưa phát hiện được đàn nhiễm. Tuy nhiên, cần có thêm những nghiên cứu nhằm làm sáng tỏ điều này. MDV truyền lây dễ dàng do sự tiếp xúc trực tiếp hay gián tiếp thông qua không khí.
Các virus có vỏ được nhân lên ở tế bào biểu mô nang lông và các tế bào này là nguồn vấy nhiễm virus ra môi trường, gây nhiễm cho những con gà khác. Virus trong lông và vảy sừng của da có thể phát tán vào bụi trong chuồng gà và duy trì tính nhiễm trong vài tháng ở 20-25°C và nhiều năm ở 4°C (Schat và Nair, 2008). Trong điều kiện thực địa, gà thường phơi nhiễm qua tiếp xúc với bụi tồn đọng và vảy sừng của da trong chuồng nuôi, qua các vật dụng được đưa vào chuồng hoặc từ nhân công. Sau khi virus nhiễm vào chuồng nuôi, nếu gà chưa chủng ngừa thì virus có thể lan truyền nhanh chóng trong đàn gà. Sau 2 tuần virus bắt đầu được bài xuất, và mạnh nhất ở giữa tuần thứ 3 và 4, khi đã nhiễm gà mang và thải virus suốt đời (Calnek và ctv, 1985).
Nhìn chung, tỷ lệ khá lớn đàn gà có mang virus (27,27%) đây là nguồn bệnh rất nguy hiểm, bệnh có thể phát ra khi sức đề kháng của gà giảm sút, không được tiêm phòng.
Ngoài ra, virus tồn tại lâu dài ở môi trường bên ngoài và trong các thể mang trùng gây nhiều rủi ro cho những gà cảm nhiễm, làm cho bệnh có thể phát ra dai dẳng trong vùng.
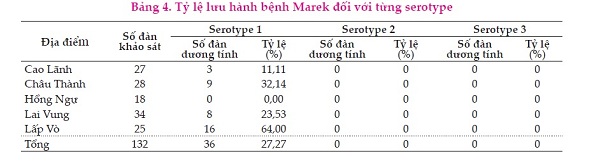
Qua kết quả Bảng 4 cho thấy có sự lưu hành serotype 1 trên đàn gà giống địa phương tại tỉnh Đồng Tháp. Mặc dù, tất cả các đàn gia cầm đều khỏe mạnh nhưng tỷ lệ đàn mang trùng khá cao, chỉ trừ huyện Hồng Ngự, các huyện còn lại đều có sự lưu hành của MDV, và chỉ có sự hiện diện của MDV serotype 1 (MDV- 1) với tỷ lệ 27,7% số đàn khảo sát dương tính, chưa phát hiện có sự lưu hành của serotype 2 và 3. Độc lực hoặc tính gây ung thư của virus chỉ có ở serotype 1 và được chia thành chủng độc lực thấp (mMDV), chủng độc vừa (vMDV), chủng rất độc (vvMDV) và chủng cực độc (vv+MDV). Serotype 2 và 3 (Herpesvirus of Turkeys, HVT) không gây khối u, thường được dùng chế vaccine. Nhiễm MDV có độc lực hoặc các chủng virus vaccine không chỉ gây kích hoạt miễn dịch tự nhiên không đặc hiệu và miễn dịch đặc hiệu có được, nhưng nó cũng có thể gây ức chế miễn dịch, đặc biệt là đối với các chủng thuộc serotype 1 có độc lực cao.
Sự tổn thương hệ thống miễn dịch, dẫn suy giảm miễn dịch làm cho bệnh dễ dàng xảy ra (Schat và ctv, 2000; Schat và ctv, 2001). Trong tự nhiên, virus trong tế bào nang lông, mãnh da bong tróc lơ lững trong không khí, xâm nhập vào cơ thể gà ký chủ qua đường hô hấp.
Sau khi vào đường hô hấp ký chủ, virus nhân lên ở đường hộ hấp, sau đó virus theo máu đi đến các tế bào lâm ba B và tế bào lâm ba T nhờ các tế bào thực bào, chủ yếu là đại thực bào. Sau giai đoạn nhiễm virus sơ phát trong thời gian 7-15 ngày, virus tiềm tàng trong các tế bào lâm ba (Baigent và ctv, 2004), virus nhân lên ở nhiều cơ quan nội tạng của gà, đặc biệt là gan, lách, thận, dạ dày tuyến và buồng trứng, các tế bào lâm ba nhiễm virus biến đổi trở thành các tế bào ung thư. Điều này dẫn đến sự hình thành các khối u (Calnek và ctv, 1985). Virus cũng được các tế bào lâm ba vận chuyển đến tế bào biểu mô nang lông và phát triển thành dạng hoàn chỉnh (có vỏ) và tiếp tục nhân lên. Hầu hết sự lây truyền MDV xảy ra ở thời kỳ này (Calnek và ctv, 1985; Baigent và ctv, 2004), khi các mảnh vụn tế bào da và nang lông phát tán ra môi trường.
Tính gây nhiễm của MDV trong bụi ở môi trường chăn nuôi duy trì trong nhiều tháng, nên khả năng gây nhiễm cho các lứa gà kế tiếp là rất cao kể cả gà tiêm phòng. Nghiên cứu của Stephen và ctv (2013) cũng đã phát hiện có đến 23,1% mẫu bụi ở các chuồng gà dương tính với MDV- 1, trong đó 26,1% được ghi nhận ở các đàn được tiêm phòng và 16,4% ở các đàn không được tiêm phòng. Kết quả nghiên cứu là dữ liệu hữu ích cho việc xây dựng phương pháp phòng bệnh phù hợp và có hiệu quả.
Có rất nhiều nghiên cứu khẳng định gà càng nhỏ càng mẫn cảm với MDV và khả năng phát triển thành thể bệnh lâm sàng càng cao, đặc biệt gà con 1 ngày tuổi mẫn cảm hơn từ 1.000-10.000 lần gà so với gà 14-26 ngày tuổi (Calnek và ctv, 1985; Biggs và Nair, 2012).
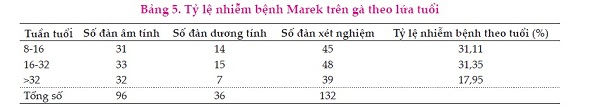
Trong nghiên cứu này, tỷ lệ phát hiện MDV- 1 từ đàn gà ở lứa tuổi 8-16 tuần tuổi, từ 16- 32 tuần tuổi và trên 32 tuần tuổi lần lượt là là 31,11; 31,35 và 17,95%, sự khác biệt giữa các tỷ lệ này không có ý nghĩa thống kê (P=0,297).
Điều này có thể do người chăn nuôi nuôi gà với nhiều độ tuổi khác nhau trong cùng 1 hộ, virus có thể lây truyền qua không khí từ những đàn lớn đã bị nhiễm sang những đàn khác, và khi gà nhiễm virus có thể phát triển thành bệnh hay không, nhưng gà sẽ mang virus suốt đời và không thể loại trừ virus khỏi cơ thể được (Calnek và ctv, 1985) đây cũng có thể là lý do làm cho tỷ lệ mang trùng không khác nhau ở các độ tuổi. Nghiên cứu của Hà Văn Quyết (2017) cũng ghi nhận virus Marek được bài thải từ gà nhiễm bệnh ở tất cả các độ tuổi, mặc dù mức độ bài thải virus giảm theo tuổi gà đồng thời có khả năng tồn tại lâu trong đàn gà mắc bệnh và có nguy cơ lây nhiễm cho các đàn gà khỏe lân cận.
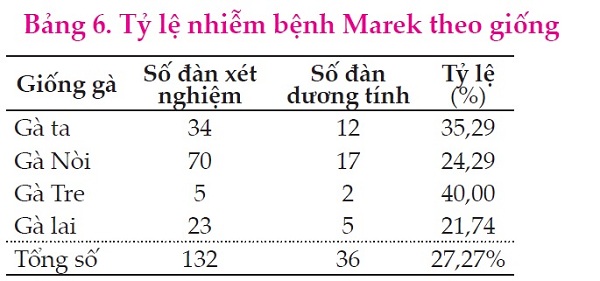
Kết quả Bảng 6 cho thấy tỷ lệ đàn nhiễm cao nhất ở Gà Tre với 40%, thấp nhất là ở nhóm Gà lai 21,74% sự khác biệt giữa các giống gà không có ý nghĩa về thống kê (P=0,536). Kết quả này khác với nghiên cứu của Biggs và Nair (2012) cho rằng những dòng gà thuần chủng có sức đề kháng bệnh Marek tốt hơn gà lai. Sự khác biệt này có thể là do số lượng mẫu thu thập trên gà Tre ít nên cần nghiên cứu thêm với số lượng đủ lớn để làm sáng tỏ vấn đề này. Do yếu tố di truyền của các giống gà khác nhau nên mức độ đề kháng với MDV ở một số giống gà khác nhau (Sharma và Stone, 1972; Calnek và ctv, 1985).
Trước khi có vaccine phòng bệnh MD, ngành chăn nuôi gia cầm đã áp dụng chọn lọc di truyền như một công cụ quan trọng để kiểm soát MD trong quá trình nuôi. Khi vaccine ra đời các phương pháp chọn lọc di truyền nhằm tạo ra những dòng gà đề kháng với bệnh này ít được quan tâm (Liu và ctv, 2001).
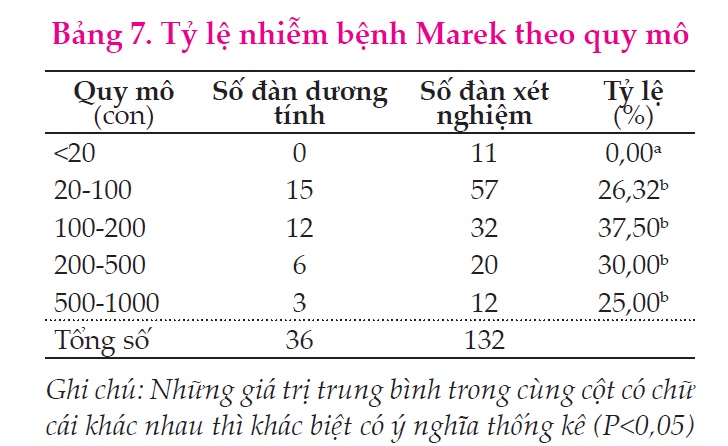
Kết quả ở Bảng 7 cho thấy đối với những đàn có quy mô <20 con đều âm tính, sai khác có ý nghĩa so với những đàn còn lại (P<0,05), những đàn còn lại quy mô trên 20 con, có tỷ lệ dương tính trong khoảng 26,32-37,5%, tuy nhiên sự sai khác giữa các tỷ lệ này không có ý nghĩa về mặt thống kê (P=0,203). Điều này có thể do MDV truyền lây chủ yếu qua đường hô hấp, do đó mật độ chăn nuôi cao ở những đàn có quy mô lớn có thể làm tăng nguy cơ truyền lây. Nghiên cứu của Heckert và ctv (2002) khi khảo sát ảnh hưởng của mật độ chăn nuôi đến khả năng miễn dịch trên gà thịt kết luận rằng mật độ chuồng nuôi tăng có thể làm ức chế miễn dịch, làm suy giảm sức đề kháng gà, điều này làm gia tăng tính cảm nhiễm của gà với MDV.
4. KẾT LUẬN
Có sự lưu hành của MDV type 1 ở đàn gà bản địa trong vùng, với tỷ lệ khá cao đàn mang virus, cho thấy nguy cơ dịch bệnh có thể xảy ra khi sức đề kháng gà giảm sút. Do đó, cần áp dụng triệt để các biện áp an toàn sinh học, đặc biệt là tiêm phòng vaccine phù hợp để phòng chống bệnh một cách hiệu quả.
Hồ Thị Việt Thu1*, Nguyễn Tâm Đồng2, Vũ Ngọc Minh Thư1 và Huỳnh Ngọc Trang1
1 Trường Đại học Cần Thơ
2 Chi cục Chăn nuôi, Thú y và Thủy sản Đồng Tháp
* Tác giả liên hệ: Tác giả liên hệ: Hồ Thị Việt Thu – Khoa Nông nghiệp Trường Đại học Cần Thơ; Điện thoại: 0918313954;
Email: htvthu@ctu.edu.vn.
Ngày nhận bài báo: 30/10/2020 – Ngày nhận bài phản biện: 27/11/2020
Ngày bài báo được chấp nhận đăng: 03/12/2020
Nguồn: Tạp chí KHKT Chăn nuôi số tháng 3.2021
Địa chỉ: Tầng 4, Tòa nhà 73, Hoàng Cầu, Ô Chợ Dừa, Đống Đa, Hà Nội.
Điện thoại: 024.36290621
Fax: 024.38691511
E – mail: tapchichannuoi@hoichannuoi.vn
Website: www.hoichannuoi.vn
TÀI LIỆU THAM KHẢO
- Baigent S.J. and Davison F. (2004). Marek’s disease virus: biology and life cycle. In: Davidson F, Nair Veds) Marek’s disease: an evolving problem, 1st Ed. Elsevier Academic Press, London, pp 62–76
- Biggs P.M. and Nair V. (2012). The long view: 40 years of Marek’s disease research andavian pathology. Avian Pathology 41: 3-9. doi: 10.1080/03079457.2011.646238.
- Calnek B.W., H.K. Adldinger and D.E. Kahn (1985). Feather follicle epithelium: A source of enveloped and infectious cell-free herpesvirus from Marek’s disease. Avian Diseases., 14: 219-33.
- Couteaudier M. and Denesvre C. (2014). Marek’s disease virus and skin interaction. Vet. Res., 2014, doi:10.1186/1297-9716-45-36
- Handberg K.J., Nielsen O.L. and Jorgenesen P.H. (2001). The use of serotype 1 and serotype 3 specific polymerase chain reaction for the detection of Marek s disease virus in chickens. 30(3): 243-49.
- Heckert R.A., Estevez I, Russek-Cohen E and Pettit- Riley R. (2002). Effects of Density and Perch Availability on the Immune Status of Broilers. Poul. Sci., 81: 451-57.
- Liu H.C., Cheng H.H., Tirunagaru V., Sofer L. and Burnside J. (2001). A strategy to identify positional candidate genes conferring Marek’s disease resistance by integrating DNA microarrays and genetic mapping. Ani. Genetics, 32(6): 351-59.
- López-Osorio P.D., Espinal-Restrepo M.A., Ramírez- Nieto G.C.,Venugopal Nair, Williams S.M., Baigenet S., Ventura-Polite C., Aranzazu-Taborda D.A. and Chaparro-Gutiérrez J.J. (2017). Molecular characterization of Marek’s disease virus in a poultry layer farm from Colombia. Poul. Sci., 96: 1598-08.
- Phan Văn Lục, Nguyễn Ngọc Hùng, Nguyễn Thành Đồng, Đặng Thị Tám và Lê Thanh Ân (2008). Mức độ nhiễm Marek và ứng dụng vaccine phòng bệnh cho đàn gà giống tại trại thực nghiệm Liên Ninh
- Lê Văn Năm (2003). Bệnh Marek – một mô hình khối u truyền nhiễm. NXB Nông nghiệp, Hà Nội.
- Hải Phương (2007). https://nhandan.com.vn/ t i n – t u c – x a – h o i / G % C 3 % A 0 – c h % E 1 % B A % B F t – nhi%E1%BB%81u-%E1%BB%9F-Long-An-v%C3%A0- Ti%E1%BB%81n-Giang-c%C3%B3-th%E1%BB%83-dob% E1%BB%87nh-Marek-479746
- Hà Văn Quyết (2017). Nghiên cứu một số đặc tính của virus gây bệnh Marek ở gà nuôi công nghiệp tại phía Bắc Việt Nam và giải pháp nâng cao hiệu lực vaccine phòng bệnh. Luận án Tiến sĩ Thú y. Trường Đại học Nông lâm Thái Nguyên.
….
- Nhũ hoá chất béo giúp tận dụng tối đa năng lượng khẩu phần
- Tỷ lệ nhiễm và các yếu tố đề kháng kháng sinh của SALMONELLA SPP trên vịt ở Đồng bằng sông Cửu Long
- Protease: Sẵn sàng cho thế giới hậu kháng sinh
- Lịch sử, hiện trạng và xu hướng phát triển của nghề nuôi thú cảnh (PET)
- Cách giảm thiểu tiêu chảy do Rotavirus ở heo con
- Axit Formic: Dùng sao cho đúng và các lựa chọn thay thế
- Tác động của thức ăn côn trùng và vi tảo đến chất lượng thịt gà
- Công nghệ phức hợp miễn dịch và tái tổ hợp trong nhà máy ấp
- 5 yếu tố cần xem xét trong một chương trình chăn nuôi heo không kháng sinh
- Bệnh bại liệt ở chó
Tin mới nhất
T3,10/03/2026
- Gia Lai: Thu hút nhiều dự án chăn nuôi heo ngay từ đầu năm
- Kỷ Nguyên Xanh, Olmix Asialand Việt Nam và VMC Việt Nam ký Biên bản ghi nhớ hợp tác phát triển chuỗi giá trị chăn nuôi
- Dự án ZOLA: Chủ động phòng ngừa bệnh truyền lây từ chợ động vật sống theo cách tiếp cận Một Sức khỏe
- Nhiều doanh nghiệp sản xuất thức ăn chăn nuôi đồng loạt tăng giá từ tháng 3/2026
- Đà Nẵng siết chặt phòng, chống bệnh dại, yêu cầu nâng tỷ lệ tiêm phòng chó mèo
- Ứng dụng khoa học và công nghệ nâng cao giá trị thương hiệu “Gà nhiều cựa Tân Sơn”
- Chăn nuôi heo khởi sắc đầu năm 2026, ngành chăn nuôi vẫn thận trọng trước nguy cơ dịch bệnh
- Olmix Asialand Việt Nam tuyển dụng Kỹ thuật Thị trường (Thuốc & Vaccine Thú y) khu vực miền Bắc
- Giá heo hơi hôm nay 6-3: Giảm giá diện rộng trên cả nước
- Trung Quốc kêu gọi giảm sản lượng heo để hạ nhiệt tình trạng dư cung
- AChaupharm: Nấm phổi gia cầm, hiểm họa thầm lặng khi giao mùa
- Chuyên gia bàn giải pháp sử dụng kháng sinh có kiểm soát trong chăn nuôi
- Ngành sữa Việt Nam: Cơ hội “bứt phá” từ nội lực
- Dịch tả heo châu Phi: Hiện trạng và giải pháp kiểm soát hiệu quả (Phần 1)
- Bộ NN&MT mở đợt ‘truy quét’ việc lạm dụng chất kích tăng trưởng, tăng trọng
- Cargill rút khỏi ngành thức ăn thủy sản tại Việt Nam, đóng cửa nhà máy tại Đồng Tháp và Long An
- Chăn nuôi dê bền vững theo chuỗi giá trị: Chủ nhà hàng là mắt xích quan trọng
- Da khỏe, lông đẹp: Chiến lược dinh dưỡng hiệu quả cho heo con sau cai sữa
- Lo ngại bệnh than, Campuchia ngừng nhập một số sản phẩm từ Thái Lan
- Cạn tiền, một công ty tại Nam Phi phải tiêu hủy hơn 350.000 con gà



























































































 đã long trọng tổ chức Hội nghị tổng kết và tri ân khách hàng với chủ đề “Đồng hành dẫn lối tương lai”. Nhân dịp này, Ban Giám đốc công ty đã […]/0.jpg)











Bình luận mới nhất