Thí nghiệm được tiến hành nhằm phân lập các dòng thực khuẩn thể (TKT) có khả năng phân giải vi khuẩn Salmonella gây bệnh trên đường tiêu hóa tại các trại gà thuộc tỉnh Tiền Giang, An Giang và Tp. Cần Thơ, đồng thời thử nghiệm khả năng phòng và điều trị của TKT phân lập được đối với vi khuẩn Salmonella trên gà Cobb 500. Kết quả phân lập được 33 TKT trong tổng số 108 mẫu thu từ 3 tỉnh chiếm tỷ lệ 30,6% trong đó mẫu ruột chiếm tỷ lệ cao nhất (13,9%). Bằng kỹ thuật PCR đã xác định được 32/108 mẫu dương tính với Salmonella mang gen invA (chiếm 29,6%), trong đó mẫu ruột chiếm tỷ cao nhất (18,5%). Đối với hai gen độc lực spvB và spiA, kết quả cho thấy tỷ lệ Salmonella được phân lập từ mẫu ruột mang hai gen này cao hơn mẫu nước và mẫu đất. Kết quả khảo sát phổ ký chủ cho thấy dòng TKT P.CR.R1 có phổ ký chủ cao nhất (15,6%). Kết quả theo dõi khả năng phòng và điều trị bệnh của TKT trên gà Cobb 500 qua 4 tuần nuôi cho thấy, nghiệm thức gây nhiễm 100µl 107 CFU/ml chủng Salmonella S.CR.R1 làm tăng tỷ lệ chết tích lũy lên 34,0%, trong khi đó, nghiệm thức gây nhiễm chủng Salmonella S.CR.R1 kết hợp với TKT tỷ lệ chết chỉ 2,9%.

1. ĐẶT VẤN ĐỀ
Ngành chăn nuôi Việt Nam đang phát triển mạnh mẽ và đang khẳng định được vị trí quan trọng trong việc cung cấp thực phẩm tiêu dùng cho con người. Tuy nhiên, bệnh về đường tiêu hóa do vi khuẩn Salmonella gây ra là căn bệnh xảy ra thường xuyên, gây thiệt hại rất lớn với tỷ lệ chết 50-90% (Nguyễn Bá Hiên và ctv, 2008). Hiện nay, để ứng phó với dịch bệnh cũng như hạn chế sự bùng phát của mầm bệnh thì biện pháp phòng trị chủ yếu là sử dụng vaccine và thuốc kháng sinh trong chăn nuôi. Tuy nhiên, do việc quá lạm dụng thuốc kháng sinh nên đã làm xuất hiện ngày càng nhiều chủng vi khuẩn kháng thuốc (Pot và ctv, 2013). Vì vậy, cần có biện pháp sinh học an toàn trong chiến lược quản lý dịch bệnh trên vật nuôi và sử dụng thực khuẩn thể (Bacteriophage) là một trong những liệu pháp đã và đang được nghiên cứu. Theo nghiên cứu của Huff và ctv (2002), nhóm đã thành công trong việc sử dụng bacteriophage (thực khuẩn thể-TKT) để điều trị viêm đường hô hấp do Salmonella gây ra trên gà thịt tại Mỹ. Bên cạnh đó, thực khuẩn thể cũng được sử dụng để phòng chống nhiễm khuẩn từ môi trường trong bệnh viện tại thành phố Moscow của Nga (Humphery, 2014). Ở Việt Nam, cũng đã có nhiều nghiên cứu về thực khuẩn thể ký sinh vi khuẩn Pseudomonas gây bệnh trên cây trồng (Nguyễn Cửu Thị Hương Giang, 1979). Nghiên cứu gần đây nhất của Nguyễn Thị Trúc Giang và ctv (2014) trong việc ứng dụng thực khuẩn thể phòng trị bệnh cháy bìa lá lúa do vi khuẩn Xanthomonas oryzae pv. Từ các nghiên cứu trên, có thể thấy biện pháp sinh học dùng TKT có thể thay thế được kháng sinh cũng như khắc phục được tình trạng kháng thuốc và kháng kháng sinh trong chăn nuôi.
2. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Thời gian và địa điểm thí nghiệm
Thí nghiệm được tiến hành từ tháng 10/2017 đến tháng 09/2018 tại phòng thí nghiệm Bộ môn Thú y, Khoa Nông nghiệp và Sinh học ứng dụng, Trường Đại học Cần Thơ.
2.2. Phương pháp lấy mẫu
Tổng cộng thu 108 mẫu, gồm 36 mẫu đất, 36 mẫu ruột và 36 mẫu nước (4 mẫu/nông hộ * 3 huyện * 3 tỉnh = 36 mẫu) trên địa bàn tỉnh An Giang, Thành phố Cần Thơ và Tiền Giang. Tất cả các mẫu đều được bảo quản ở 40C và tiến hành nuôi cấy phân lập trong 24 giờ sau khi thu.
Mẫu nước: Dùng ống tiêm vô trùng (5 ml) hút trầm tích nước ở nhiều vị trí khác nhau cho vào ống falcon (50ml) vô trùng đậy kín nắp (Clesceri và ctv, 1998).
Mẫu đất: Thu tại 5 vị trí theo quy tắc đường chéo, mỗi vị trí lấy 10g và được trộn đều thành 1 mẫu (Sava, 1994).
Mẫu ruột: Chọn ngẫu nhiên 4 cá thể gà trong nông hộ để mổ thu mẫu từ phần tá tràng đến trực tràng gà. Mẫu được cho vào ống fal-con vô trùng, ghi ký hiệu và cho vào thùng đá đem về phòng thí nghiệm. Tất cả mẫu phải được tiến hành nuôi cấy phân lập trong 24 giờ.
2.3. Phân lập và nuôi cấy vi khuẩn Salmo-nella từ các mẫu thu được
2.3.1. Tiền tăng sinh trong môi trường Buffered Pepton Water (BPW)
Mẫu nước: Cho 1 ml mẫu vào ống nghiệm vô trùng có chứa dung dịch BPW với tỷ lệ 1:9 đồng nhất hỗn hợp và đem ủ ở 370C qua đêm trong tủ ấm.
Mẫu đất và mẫu ruột: 10g đất được nghiền mịn cho vào cốc thủy tinh, tương tự 9g dịch ruột được cho vào cốc thủy tinh, sau đó lần lượt thêm 20-30ml nước cất vô trùng vào các cốc thủy tinh, khuấy đều đến khi hỗn hợp hòa tan, để yên trong 5 phút, hút 1ml dịch huyền phù phía trên cho vào ống nghiệm vô trùng và tiến hành tăng sinh giống như mẫu nước thải.
2.3.2. Tăng sinh trong môi trường Hajna TeTrathionate Broth: Hút 1 ml dung dịch tiền tăng sinh vào dung dịch Hajna TeTrathionate Broth với tỷ lệ 1:9, ủ ở 370C trong 24 giờ.
2.3.3. Phân lập trên môi trường Mannitol Ly-sine Crystal Violet Brilliant Green Agar (ML-CBA)
Sử dụng que cấy đầu tròn thu một vòng canh khuẩn cấy lên đĩa petri chứa môi trường MLCB Agar, ủ ở 370C 24 giờ. Sau 24 giờ, chọn 2-3 khuẩn lạc điển hình, đặc trưng của vi khuẩn Salmonella cấy thuần lên đĩa petri chứa môi trường MLCB Agar, ủ ở 370C trong 24 giờ. Tiếp theo, chọn khuẩn lạc điển hình cấy trên TSA, ủ ở 370C trong 24 giờ, thu hoạch và giữ giống.
2.4. Sử dụng phương pháp PCR để xác định vi khuẩn Salmonella
2.4.1. Ly trích ADN của vi khuẩn Salmonella
Vi khuẩn sau khi được tăng sinh trên môi trường TSA, thu sinh khối cho vào 500µl nước tinh khiết vô trùng, sốc nhiệt ở 100oC trong 10 phút, ly tâm 15.000 vòng/phút trong 10 phút. Hút phần dịch lỏng chứa ADN của Salmonella phía trên cho vào ống eppendorf mới (dựa theo phương pháp của Keegan và ctv, 2005) và trữ ở -20oC. Các primer invA-1: 5′-ACA GTG CTC GTT TAC GAC CTG AAT-3′, invA-2: 5′-AGA CGA CTG GTA CTG ATC GAT AAT-3′, spiA-1: 5’-CCA GGG GTC GTT AGT GTA TTG CGT GAG ATG-3’, spiA-2: 5’-CGC GTA ACA AAG AAC CCG TAG TGA TGG ATT-3, spvB-1: 5’-CTA TCA GCC CCG CAC GGA GAG CAG TTT TTA-3’ và spvB-2: 5’-GGA GGA GGC GGT GGC GGT GGC ATC ATA-3’ được sử dụng để xác định vi khuẩn Salmonella (invA) và tỷ lệ hiện diện của các gen độc lực spiA và spvB với kích thước khuếch đại lần lượt là 243, 550 và 717 bp (Chiu và Ou, 1996; Skyberg và ctv, 2006).
2.4.2. Phân lập các thực khuẩn thể phân giải vi khuẩn Salmonella
Hút 2ml dung dịch tăng sinh trong môi trường Hajna Tetrathionate Broth (sau khi ủ 370C, 24 giờ) cho vào ống nghiệm chứa 10ml TSB, ủ 370C, 24 giờ; hút 4ml dung dịch cho vào ống Facol 15ml, bổ sung 4ml chloroform, lắc đều trên vortex, ly tâm 6.000 vòng/phút ở 40C trong 15 phút. Sau đó, hút 3ml phần dịch trong chứa TKT phía trên cho vào 2 ống eppendorf (mỗi ống 1,5ml). TKT được kiểm tra bằng cách hút 0,1ml huyền phù vi khuẩn Salmonella (108 cfu/ml) cho vào đĩa petri, tiếp theo cho khoảng 10-12ml TSB có 0,6% agar, lắc đều đĩa petri cho đồng nhất hỗn hợp. Sau đó, nhỏ 50 µl dung dịch TKT lên những vị trí khác nhau trên bề mặt đĩa thạch TSB chứa vi khuẩn Salmonella, ủ ở 370C trong 24 giờ, quan sát sự hình thành các vòng vô khuẩn (plaques).
2.5. Tách ròng và nhân mật số KTK có khả năng phân giải vi khuẩn Salmonella
Pha loãng nồng độ của TKT từ 10-1 đến 10-5 pfu/ml. Hút 0,1ml từng TKT đã được pha loãng cho vào từng đĩa petri vô trùng cùng với 0,1ml huyền phù vi khuẩn Salmonella ký chủ (108 cfu/ml). Sau đó, cho khoảng 10-12ml TSB có 0,6% agar đã nấu tan, lắc đều đĩa cho đồng nhất hỗn hợp, ủ ở 370C. Sau 24 giờ tiến hành quan sát và thu hoạch TKT bằng cách sử dụng đầu col vô trùng chấm lên trung tâm của vết tan riêng lẻ, cho vào ống eppendorf chứa 0,9ml nước cất vô trùng, vortex và tiếp tục pha loãng đến khi nồng độ TKT là 10-5 pfu/ml (Poxleitner và ctv, 2017). Lặp lại thí nghiệm đến khi các vòng vô khuẩn đồng nhất về hình dạng và kích thước.
2.6. Xác định phổ ký chủ của thực khuẩn thể mẫn cảm trên Salmonella
Sử dụng phương pháp khảo sát vết tan bằng agar hai lớp với bố trí hoàn toàn ngẫu nhiên 3 lần lặp lại (Kropinski và ctv, 2009). Chuẩn bị đĩa môi trường TSB 1,7% agar đã được kẻ và đánh số từng TKT, cho vào đĩa hỗn hợp gồm 10ml TSB 0,5% agar và 1ml huyền phù Salmonella (OD600 = 0,3-0,5) và phơi đĩa 10 phút. Hút 2µl từng TKT nhỏ vào ô kẻ tương ứng và ủ ở 37oC trong 24 giờ. Quan sát sự xuất hiện vết tan.
2.7. Thử nghiệm và đánh gái khả năng điều trị bệnh của thực khuẩn thể đối với vi khuẩn Salmonella trên gà
Chuẩn bị chuồng trại: sát trùng chuồng trại, máng ăn, máng uống, nơi nuôi nhốt phải cách biệt để tiến hành công cường độc trên gà.
Chuẩn bị gà: 200 con gà thuộc giống gà thịt Cobb 500 trong giai đoạn 1 ngày tuổi.
Chủng vi khuẩn Salmonella và TKT: chọn chủng Salmonella mang 3 gen độc và TKT có phổ ký chủ rộng để tiến hành thí nghiệm.
Bố trí thí nghiệm: Tổng số 200 cá thể gà được chia thành bốn nhóm hoàn toàn ngẫu nhiên (4 nghiệm thức-NT) với 5 lần lặp lại (mỗi đơn vị thí nghiệm gồm 10 con gà x 4 x 5 = 200 con). Gà được nuôi trong chuồng thông thoáng và được phân chia lô.
Các nghiệm thức bao gồm: NT1: cho uống Salmonella 100 µl 108 CFU/ml không TKT; NT2: cho uống TKT 100 µl 109 PFU/ml không Salmonella; NT3: cho uống TKT 100 µl 109 PFU/ml và Salmonella 100 µl 108 CFU/ml; NT4: Đối chứng (không cho uống Salmonella và TKT). Theo dõi tình trạng sức khoẻ và tỷ lệ chết ở 7, 14 và 35 ngày sau khi thử nghiệm (Wernicki và ctv, 2017).
Phương pháp chủng bệnh: được tiến hành công cường độc các dòng vi khuẩn Salmonella có độc lực đã phân lập được ở thí nghiệm trên bằng cách cho uống trực tiếp.
2.8. Xử lý số liệu
Số liệu được xử lý bằng phần mềm Excel 2016 và xử lý thống kê bằng phần mềm Mini-tab 17.0
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Tỉ lệ hiện diện của vi khuẩn Salmonella
Tổng cộng 108 mẫu vi khuẩn được phân lập từ trang trại nuôi gà thuộc tỉnh Tiền Giang, An Giang và Cần Thơ. Kết quả nhận diện vi khuẩn Salmonella thông qua gen invA bằng phương pháp PCR cho thấy, vi khuẩn Salmo-nella hiện diện với tỷ lệ khá cao (29,6%). Trong đó, tỷ lệ dương tính của vi khuẩn Salmonella ở mẫu ruột (18,5%) cao hơn so với nước thải (7,4%) và mẫu đất (3,7%) (Bảng 1). Cụ thể ở 3 tỉnh An Giang, Cần Thơ và Tiền Giang, mẫu ruột chiếm tỷ lệ lần lượt là 16,7; 19,4 và 19,4% cao hơn mẫu đất (5,6; 2,8 và 2,8%) và mẫu nước (8,3; 11,1 và 2,8%). Điều này cho thấy, vi khuẩn Salmonella phân bố rộng rãi trong môi trường, có thể tìm thấy trong đất, nước, thực phẩm và đường ruột của người và vật nuôi (Arestrup và ctv, 2003). Trong nghiên cứu của Tran và ctv (2004); Vo và ctv (2006) cũng đã chỉ ra sự lưu hành của Salmonella với tỷ lệ cao ở miền Nam Việt Nam, chúng hiện diện trong phân người, phân gia súc (heo, bò, gia cầm), trên các sản phẩm thịt gia súc, hải sản. Như vậy, có sự hiện diện khá cao của vi khuẩn Sal-monella trong nghiên cứu hiện tại, kết quả này làm tiền đề cho việc phân lập các dòng thực khuẩn thể.
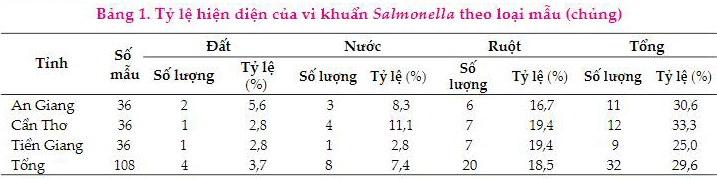
3.2. Tỷ lệ hiện diện của các gen độc lực
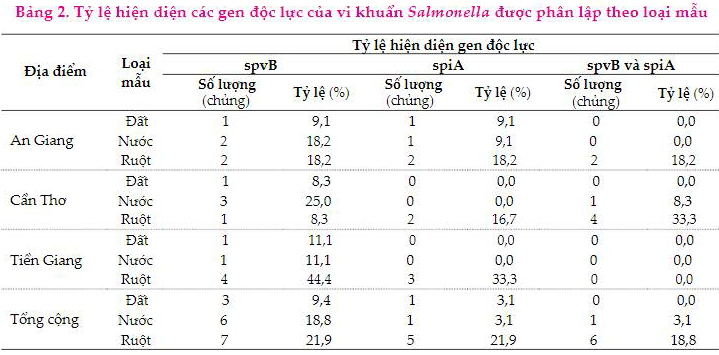
Kết quả ở Bảng 2 cho thấy tỷ lệ Salmonella được phân lập từ mẫu ruột mang gen độc spvB (21,9%) cao hơn mẫu nước (18,8%) và mẫu đất (9,4%). Tương tự, đối với gen spiA, kết quả cũng cho thấy, tỷ lệ hiện diện gen spiA cao ở mẫu ruột (21,9%), tiếp theo là mẫu đất và mẫu nước (3,1%). Bên cạnh đó, kết quả khảo sát các vi khuẩn Salmonella mang cả hai gen spvB và spiA cũng cho thấy, vi khuẩn mang hai gen này hiện diện cao nhất ở mẫu ruột (18,8%), tiếp theo là mẫu nước (3,1%) và không tìm thấy ở các vi khuẩn Salmonella phân lập từ đất.
3.3. Tỷ lệ hiện diện của thực khuẩn thể
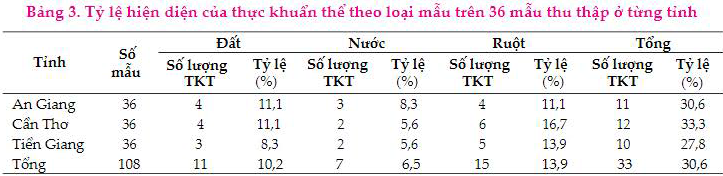
Kết quả phân lập TKT ở Bảng 3 cho thấy, TKT được phân lập hiện diện với tỷ lệ khá cao là 30,6% (33 TKT). Trong đó, đối với mẫu đất phân lập được 11 TKT, trong đó An Giang và Cần Thơ đều phân lập được 4/36 TKT chiếm 11,1% và Tiền Giang phân lập được thấp hơn với 3/36 TKT (8,3%). Đối với mẫu nước, kết quả khảo sát cho thấy, TKT phân lập được ở An Giang (3/36 mẫu, với tỷ lệ 8,3%) cao hơn so với Cần Thơ và Tiền Giang với số lượng TKT 2/36 mẫu (5,6%). Ngược lại đối với mẫu ruột, số TKT phân lập được ở An Giang là thấp nhất với 4/36 mẫu (11,1%), cao nhất là Cần Thơ với 6/36 mẫu (16,7%) và tiếp theo là Tiền Giang với 5/36 mẫu (13,9%). Như vậy, trong nghiên cứu hiện tại số lượng thực khuẩn thể có sự khác nhau và đều được tìm thấy ở mẫu ruột (15/108 mẫu), mẫu đất (11/108 mẫu) và mẫu nước (7/108 mẫu).
3.4. Phổ ký chủ của các thực khuẩn thể phân lập được trên 32 chủng vi khuẩn Samonella
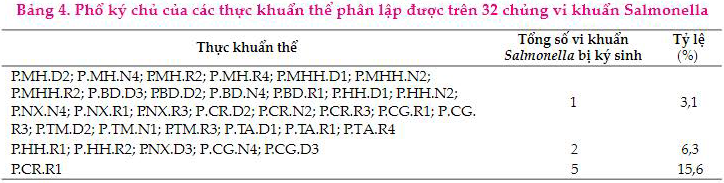
Kết quả Bảng 4 cho thấy, phổ ký chủ của các thực khuẩn thể phân lập được trên 32 dòng vi khuẩn Salmonella không có sự biến động nhiều về số lượng vi khuẩn bị ký sinh, thấp nhất 1 vi khuẩn Salmonella chiếm tỷ lệ 3,1% và cao nhất là 5 thực khuẩn thể chiếm tỷ lệ 15,3% (P.CR.R1). Kết quả nghiên cứu của Tanji và ctv (2004), Pal và ctv (2007) và Koskella và Brockhurst (2014) cho rằng, hiện tượng trên có thể do sự xuất hiện của các thể vi khuẩn đột biến kháng thực khuẩn thể làm cho việc sử dụng thực khuẩn thể không còn hiệu quả. Tuy nhiên, có thể khắc phục hiện tượng này bằng cách sử dụng hỗn hợp nhiều thực khuẩn thể để có thể mở rộng phổ ký chủ, tăng khả năng điều trị bệnh.
3.5. Thử nghiệm khả năng điều trị bệnh của thực khuẩn thể đối với vi khuẩn Samonella ở gà
Dòng thực khuẩn thể P.CR.R1 và chủng vi khuẩn Salmonella S.CR.R1 được phân lập ở Cần Thơ được chọn để thử nghiệm trên gà. Khả năng gây chết 50% (LD50) của vi khuẩn Salmonella trên gà được tham khảo theo nồng độ thí nghiệm của Wernicki và ctv (2017) là 5×108 CFU/ml và TKT được sử dụng để điều trị bệnh trên gà với nồng độ là 109 PFU/ml.
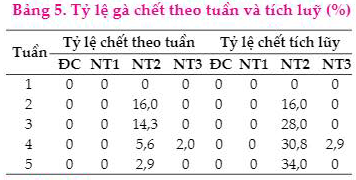
Ở NTĐC và NT1 không có cá thể gà nào chết chứng tỏ gà đưa vào thí nghiệm có sức khỏe tốt. Tuy nhiên, khi tiến hành gây nhiễm Salmonella lên gà Cobb 500 (NT2), gà bắt đầu chết từ tuần thứ 2 đến tuần thứ 5 với tổng số gà chết tích lũy chiếm tỷ lệ là 34%. Trong khi đó, ở NT3, khi tiến hành bổ sung cùng lúc vi khuẩn Salmonella và TKT đã làm giảm tỷ lệ chết tích lũy của gà xuống chỉ còn 2,9%. Bên cạnh đó, tỷ lệ chết của gà cao nhất ở tuần thứ 2 (16%), sau đó giảm xuống 14,3% ở tuần thứ 3; 5,6% ở tuần thứ 4 và chỉ còn 2,9% ở tuần thứ 5. Tuy nhiên, ở cùng các thời điểm trên, ở NT3 thể hiện số lượng gà chết tương đối thấp, chỉ tìm thấy 2% gà chết ở tuần thứ 4. Từ các kết quả trên có thể thấy, sự hiện diện của thực khuẩn thể P.CR.R1 ở NT3 đem lại sự an toàn cho gà và có khả năng kiểm soát chủng vi khuẩn Salmonella S.CR.R1 nhiễm bệnh trên gà, cụ thể đã làm giảm tỷ lệ chết tích lũy từ 34% xuống 2,9%, vì vậy có thể ứng dụng TKT này trong việc điều trị bệnh do Salmonella gây ra trên gà.
4. KẾT LUẬN
Tỷ lệ dương tính với vi khuẩn Salmonella trên tổng số mẫu thu thập ở An Giang, Tiền Giang và Cần Thơ là 29,6% (32/108 mẫu). Số TKT phân lập được là 33 với tỷ lệ 30,6%, trong đó tuyển chọn được dòng TKT S.CR.R1 có tiềm năng trong điều trị bệnh do vi khuẩn Salmonella gây ra trên đường tiêu hóa của gà. Khi bổ sung dòng TKT P.CR.R1 với nồng độ 106 PFU/ml đã làm giảm tỷ lệ chết của gà từ 34% xuống 2,9%
Souvannaty Vannapaseut và CS
Trường Đại học Cần Thơ
- Nhũ hoá chất béo giúp tận dụng tối đa năng lượng khẩu phần
- Tỷ lệ nhiễm và các yếu tố đề kháng kháng sinh của SALMONELLA SPP trên vịt ở Đồng bằng sông Cửu Long
- Protease: Sẵn sàng cho thế giới hậu kháng sinh
- Lịch sử, hiện trạng và xu hướng phát triển của nghề nuôi thú cảnh (PET)
- Cách giảm thiểu tiêu chảy do Rotavirus ở heo con
- Axit Formic: Dùng sao cho đúng và các lựa chọn thay thế
- Tác động của thức ăn côn trùng và vi tảo đến chất lượng thịt gà
- Công nghệ phức hợp miễn dịch và tái tổ hợp trong nhà máy ấp
- 5 yếu tố cần xem xét trong một chương trình chăn nuôi heo không kháng sinh
- Bệnh bại liệt ở chó
Tin mới nhất
T5,05/03/2026
- Trung Quốc kêu gọi giảm sản lượng heo để hạ nhiệt tình trạng dư cung
- ELT Science – Tiên phong chăm sóc sức khỏe thú cưng
- Nuôi dế cùng chim cút, sự kết hợp hoàn hảo
- Tình hình chăn nuôi cả nước tháng 2/2026
- Vào vụ cưa sừng hươu, nông dân Hà Tĩnh thu về hơn 200 tỷ đồng
- USDA: Dự báo sản lượng ngô và đậu tương thế giới mùa vụ 2025/2026
- Thái Nguyên: Hướng đi bền vững trong phát triển chăn nuôi
- Khởi động Dự án MekongElevate: “Thích ứng xanh và bền vững cho các cộng đồng dân tộc thiểu số” tại Đắk Lắk
- Chàng trai Hà Tĩnh thu hơn 6 tỷ mỗi năm nhờ nuôi lươn kiểu mới
- TP. Hồ Chí Minh: Hướng dẫn xác định khu vực không được phép chăn nuôi
- AChaupharm: Nấm phổi gia cầm, hiểm họa thầm lặng khi giao mùa
- Chuyên gia bàn giải pháp sử dụng kháng sinh có kiểm soát trong chăn nuôi
- Ngành sữa Việt Nam: Cơ hội “bứt phá” từ nội lực
- Dịch tả heo châu Phi: Hiện trạng và giải pháp kiểm soát hiệu quả (Phần 1)
- Bộ NN&MT mở đợt ‘truy quét’ việc lạm dụng chất kích tăng trưởng, tăng trọng
- Cargill rút khỏi ngành thức ăn thủy sản tại Việt Nam, đóng cửa nhà máy tại Đồng Tháp và Long An
- Chăn nuôi dê bền vững theo chuỗi giá trị: Chủ nhà hàng là mắt xích quan trọng
- Da khỏe, lông đẹp: Chiến lược dinh dưỡng hiệu quả cho heo con sau cai sữa
- Lo ngại bệnh than, Campuchia ngừng nhập một số sản phẩm từ Thái Lan
- Cạn tiền, một công ty tại Nam Phi phải tiêu hủy hơn 350.000 con gà


























































































 đã long trọng tổ chức Hội nghị tổng kết và tri ân khách hàng với chủ đề “Đồng hành dẫn lối tương lai”. Nhân dịp này, Ban Giám đốc công ty đã […]/0.jpg)











Bình luận mới nhất