[Tạp chí Chăn nuôi Việt Nam] – Trong nghiên cứu này, chúng tôi chứng minh rằng chủng ngừa vắc – xin bằng đường miệng ở lợn rừng chưa lây nhiễm với chủng virus bệnh Dịch tả lợn châu Phi (ASFV) nhược độc thuộc serotype II được phân lập ở Latvia năm 2017 (Lv17 / WB / Rie1) đã bảo vệ được 92% số lợn trước thử thách bởi virus ASF có độc lực (Arm07). Đây là báo cáo đầu tiên về một loại vắc-xin đầy hứa hẹn chống lại vi-rút ASF trên lợn rừng bằng cách uống. Những nghiên cứu sâu hơn, lặp đi lặp lại và thử nghiệm quá liều đánh giá sự an toàn, xác minh tính ổn định di truyền của virus vắc-xin để xác nhận rằng: chủng virus Lv17 / WB / Rie1 có thể được sử dụng cho lợn rừng trong kiểm soát ASF.
Bệnh Dịch tả heo châu Phi là mối đe dọa đáng kể nhất đối với ngành chăn nuôi lợn trên toàn thế giới, đã lan rộng đến hơn 55 quốc gia, trên ba lục địa và nó ảnh hưởng đến hơn 77% quần thể lợn trên thế giới. Theo Liên minh châu Âu, lợn rừng (Sus Scrofa) là vật chủ bị ảnh hưởng nghiêm trọng. Những lý do chính cho sự lây lan chưa từng thấy và liên tục của ASF ở châu Âu là các hoạt động thương mại, sự di chuyển liên tục của lợn rừng bị nhiễm bệnh,số lượng lợn giữa các khu vực và thiếu vắc-xin để ngăn ngừa.
Trong nghiên cứu này, chúng tôi chứng minh rằng chủng ngừa Vac- xin bằng đường miệng ở lợn rừng chưa lây nhiễm với chủng virus ASF nhược độc thuộc serotype II được phân lập ở Latvia năm 2017 (Lv17 / WB / Rie1) đã bảo vệ được 92% số lợn trước thử thách bởi virus ASF có độc lực (Arm07). Đây là báo cáo đầu tiên về một loại vắc-xin đầy hứa hẹn chống lại vi-rút ASF trên lợn rừng bằng cách uống.
Những nghiên cứu sâu hơn, lặp đi lặp lại và thử nghiệm quá liều đánh giá sự an toàn, xác minh tính ổn định di truyền của virus vắc-xin để xác nhận rằng: chủng virus Lv17 / WB / Rie1 có thể được sử dụng cho lợn rừng trong kiểm soát ASF.
I. GIỚI THIỆU
Bệnh Dịch tả heo châu Phi (ASF) là một trong những bệnh do virus phức tạp và tàn phá nhất. Các chủng virus ASF (ASFV) gây sốt xuất huyết cấp tính và á cấp tính ở động vật nhiễm bệnh với tỷ lệ tử vong lên tới 100%. Do tác động đến kinh tế xã hội và số lượng lợn trong ổ dịch bị giết hại quá lớn, ASF được Tổ chức Thú y Thế giới đưa vào danh sách những bệnh truyền nhiễm đáng chú ý.
Sau khi được phát hiệ , chủng ASFV genotyp2 lây lan từ Đông Phi vào Georgia rồi lan sang Đông Âu từ năm 2007, lưu hành tại Liên minh châu Âu từ năm 2014 và ở châu Á kể từ năm 2018. Bằng các biện pháp kiểm soát, người ta thông báo bệnh tiếp tục lây từ lợn rừng (Sus Scrofa) sang lợn nhà ở các trang trại mà không có vắc-xin cũng như những biện pháp điều trị cụ thể sẵn có để chống lại tác hại của loại virus này.
Các biện pháp kiểm soát chỉ bao gồm giảm số lợn nuôi và lợn hoang dã bị nhiễm, cũng như hạn chế việc vận chuyển, buôn bán lợn sống và các sản phẩm có nguồn gốc ở cấp khu vực, quốc gia và quốc tế.
Do đó, ASF đang là mối đe dọa đáng kể nhất đối với ngành chăn nuôi lợn hiện nay trên toàn thế giới. Hiện tại, ASF ảnh hưởng đến hơn 55 quốc gia trên 3 châu lục, bao gồm cả Trung Quốc, nơi chứa gần 1/2 số lợn Thế giới.
Dịch tễ học của ASF thay đổi đáng kể tùy thuộc vào đặc điểm của chủng virus lưu hành, sự hiện diện của vật chủ và ổ chứa hoang dã, an toàn sinh học trang trại, điều kiện môi trường và hành vi của con người.
Chín thành viên của Liên minh châu Âu đã báo cáo có sự lưu hành của ASFV trong 5 năm qua là: Litva, Ba Lan, Latvia, Estonia, Cộng hòa Séc, Romania, Hungary, Bulgaria và Bỉ. Trong tất cả những các quốc gia ngoại trừ Romania, lợn rừng là vật chủ chính bị ảnh hưởng bởi căn bệnh này, chiếm hơn 90% các vụ dịch trong Liên minh.
Một phân tích dịch tễ học ở Estonia đã kết luận rằng sự hiện diện của ASFV trong lợn rừng là yếu tố nguy cơ chính gây ra dịch bệnh ở lợn nuôi trong nước. sự lan tỏa xuyên biên giới của ASF xảy ra do sự di chuyển bất hợp pháp của lợn bị nhiễm bệnh, của thịt lợn hoặc các sản phẩm chế biến từ thịt lợn bị nhiễm ASFV . Đây vẫn là những yếu tố nguy cơ chính cho sự lây lan của ASF trên một khoảng cach địa lý lớn và lan truyền tại địa phương.Sự lây nhiễm còn xảy ra thông qua các quá trình nhiễm trùng tự do ở lợn rừng trong tự nhiên, giữa virus đặc hữu trên quần thể lợn rừng ở Liên minh châu Âu.
ASF xảy ra trong một số hình thức lâm sàng có thể từ cấp tính đến cận lâm sàng. Biểu hiện lâm sàng phụ thuộc vào độc lực của chủng virus phân lập, vật chủ, liều lượng và đường lây nhiễm và các yếu tố khác. Thời gian ủ bệnh dao động từ 3 đến 19 ngày.
Các dấu hiệu và tổn thương lâm sàng liên quan đến sung huyết, cầm máu và thay đổi huyết động như xuất huyết, phù, cổ trướng và sốc, cũng như rối loạn chức năng của tiêu hóa và hô hấp hệ thống. Phạm vi tử vong thay đổi từ 10 đến 100%, tùy thuộc vào độc lực của virus phân lập.
Các chủng ASFV serotyp II gây dịch bệnh vùng Á-Âu có độc lực cao và gây ra một hình thức lâm sàng cấp tính có tỷ lệ tử vong lên đến gần 100% ở lợn nhà và lợn rừng.Tuy nhiên những báo cáo gần đây cho biết còn có các chủng ASFV độc lực trung bình đang lưu hành ở châu Âu.
Nhìn chung, việc phát triển vắc-xin đã bị cản trở bởi sự phức tạp di truyền của ASFV, những hiểu biêt chưa đầy đủ về phương thức nhiễm trùng và miễn dịch của ASFV, vấn đề về kháng thể trung hòa và những khó khăn kỹ thuật nuôi cấy , đặc biệt là thiếu cácdòng tế bào ổn định .
Sự tái xuất hiện gần đây của ASF ở châu Âu đã tăng lên quan tâm đến việc phát triển một loại vắc-xin hiệu quả chống lại ASF.
Nỗ lực tiêm phòng cho động vật sử dụng virus bất hoạt hoặc tiểu đơn vị vắc-xin đã thất bại trong việc tạo ra khả năng miễn dịch bảo vệ.
Vắc-xin sống nhược độc do truyền đời liên tiếp trong nuôi cấy tế bào hoặc thông qua việc xóa gen có thể tạo ra sự bảo vệ một phần hoặc toàn bộ.
Trên thực tế, một số trình tự bộ gen ASFV hiện đã có sẵn, một số chùng virus nhược độc tự nhiên cũng đã được phân lập tại thực địa,một số chủng ASFV nhược độc cũng đã được tạo ra bằng việc xác định những gen liên quan đến độc lực và trốn tránh miễn dịch của virus có thể được lựa chọn đề phát triển văc-xin.Một chủng ASFV có độc lực yếu, không gây xuất huyết đã được phân lập vào năm 2017 từ một con lợn rừng được săn lùng ở Latvia (Lv17 / WB / Rie1) (25). Thí nghiệm gây nhiếm trên lợn nhà với chủng này cung cấp sự bảo vệ hoàn toàn chống lại khả năng gây bệnh của chủng ASFV cường độc serotyp II, cho thấy tiềm năng sử dụng Lv17 / WB / Rie1 như một loại vắc-xin nhược độc.
Mặc dù rất quan tâm đến vắc-xin ASFV cho lợn rừng, chúng tôi nhận thức được các thử nghiệm tiêm chủng chỉ ở lợn nhà(xem tổng quan thư mục trong Bảng bổ sung 1). Tầm quan trọng của việc tiêm phòng lợn rừng đã được chứng minh trongnhững năm2000 khi Dịch tả lợn cổ điển ảnh hưởng đến các Quốc gia châu Âu khac nhau . Mục đích của nghiên cứu thực nghiệm này là để đánh giá khả năng miễn dịch của lợn rừng với chủng Lv17 / WB / Rie1 như thế nào để chống lại chủng ASFV cường độc serotyp II phân lập (Arm07).
II. VẬT LIỆU VÀ PHƯƠNG PHÁP
1. Động vật
18 con lợn rừng 3 -4 tháng tuổi nặng 10 -15 kg được lấy từ một trang trại lợn rừng thương mại ở Extremadura, Tây Ban Nha.Lợn con chưa được tiêm phòng cchống lại bất kỳ bệnh truyền nhiễm nào.
Lợn rừng thí nghiệm đã thử nghiệm âm tính với các mầm bệnh chính của lợn trong khu vực: Aujeszky virus, Mycobacterium bovis, Mycoplasma pneumoniae và porcine Circovirus typ 2.
Lợn con được nuôi giữ tại phòng an toàn sinh học BSL-3 các cơ sở của Trung tâm VISAVET tại Đại học Madrid.
Động vật được thích nghi trong 2 tuần trước thí nghiệm bắt đầu. Trong quá trình thử nghiệm, lợn rừng tự do tiếp cận với thực phẩm và nước uống. Tất cả các thí nghiệm đã được thực hiện theo quy định của châu Âu, quốc gia và khu vực và được chấp thuận bởi Ủy ban đạo đức của Comunidad de Madrid(tham khảo PROEX 124/18).
2.Cách ly ASFV
Kiểu gen p72 II chủng Lv17 / WB / Rie1 nhược độc không hemaduptbing đã được sử dụng để tiêm chủng. Chủng này trước đây đã được thử nghiệm trên lợn nhà. Kiểu hình không tan máu có liên quan đến một adenosine giải phóng bằng tạo ra protein cắt từ CD2- giống như trình tự mã hóa trong gen EP402R (bằng sáng chế của Tây Ban Nha PCT / 2018/000069). Việc xóa gen tại vị trí này tương ứng với gen ở vị trí 395 trong bộ gen tham chiếu ASFV Georgia 2007/1 (GenBank FR682468). Virus đã phát triển 7 ngày trong bạch cầu đơn nhân máu, sau đó môi trường nuôi cấy chứa virus ngoại bào được thu thập, ly tâm ở tốc độ thấp để loại bỏ các mảnh vụn của tế bào và sau đó ở mức tốc độ cao để lắng đọng virus. Các hạt lắng trong dung dịch muối đệm phốt phát (PBS), được chuẩn độ trong bạch cầu đơn nhân của máu lợn và được sử dụng trong các thí nghiệm gây miễn dịch.
Hiệu giá virus được định nghĩa là lượng virus gây ra hiệu ứng tế bào trong 50% mẫu nuôi cấy bị nhiễm bệnh (TCID50 / ml), theo ước tính của phương pháp nhuộm immunoperoxidase.
Đối với các thử nghiệm thử thách, ASFV cường độc , tan máu genotype II chủng Arm07 đã được sử dụng. Virus được nhân lên trong bạch cầu đơn nhân máu như mô tả. Hiệu giá virus được định nghĩa là lượng virus gây ra sự hấp thu trong 50% môi trường nuôi cấy bị nhiễm bệnh (HAD50 / ml / TCID50/ml).
Bảng 1- Danh sách các mô của lợn sau khi chêt được xet nghiệm AND của ASFV bằng kỹ thuật Real-time -PCR
|
CÁC MÔ ĐƯỢC THEO DÕI |
|
|
Tủy xương |
Hạch bạch huyết trung thất |
|
Não |
Hạch bạch huyết trung thất |
|
Hạch lympho hệ tiêu hóa |
Hạch bạch huyết |
|
Tim |
Hạch bạch huyết |
|
Hạch lympho vùng bẹn |
Hạch bạch huyết |
|
Thận |
Lách |
|
Gan |
Hạch dưới màng cứng |
|
Phổi |
Bàng quang tiết niệu |
3.Thử thách và chủng ngừa Lợn rừng
12 con lợn rừng được nuôi tại các cơ sở BSL-3 để tiến hành thử nghiệm tiêm chủng. Ban đầu, 9 con lợn rừng được đưa vắc-xin bằng đường miệng với liều 104 TCID50 của chủng Lv17 / WB / Rie1 ASFV.
Sau đó, 3 con lợn rừng còn lại được tiếp xúc với 9 lợn được tiêm phòng qua đường tiếp xúc (sau đây gọi là VContact) từ 7 và 15 ngày sau khi chủng ngừa để kiểm tra truyền ngang của virus vắc-xin tại các thời điểm khác nhau.
Thời gian theo dõi kéo dài 30 ngày để cho phép phát triển một phản ứng miễn dịch. Sau đó, một thử thách tiếp xúc với lợn gây nhiễm virús cường độc để đánh giá khả năng miễn dịch bảo vệ :9 lợn được tiêm phòng đã tiếp xúc với 4 con lợn rừng khác. Những con lợn rừng này được tiêm bắp với liều 10 HAD50 của chủng ASFV Arm07 cường độc cùng ngày.
Vào 30 ngày sau tiêm phòng, hai con lợn rừng khác (tiếp xuc muộn) đã được tiếp xúc với tất cả những lợn thí nghiệm ở lô tiêm phòng văc-xin, và lợn gây nhiễm virus cường độc.
Như vậy, tất cả 12 con lợn rừng đã được tiêm phòng, 4 con lợn rừng tiêm bắp với chủng Arm07 cường độc và 2 con lợn rừng tiếp xúc muộn sau được được theo dõi trong 24 ngày sau thử thách, tương ứng với 54 ngày sau tiêm chủng.
Trong thời gian này, mọi hoạt động của đàn lợn được theo dõi 24 h/ngày bằng máy quay video. Dấu hiệu lâm sàng được ghi nhận trên cơ sở hàng ngày như mô tả, những dấu hiệu lâm sàng bao gồm chán ăn, xuất huyết da hoặc tím tái, sưng khớp, suy hô hấp, tiết dịch mắt và biểu hiện tiêu hóa.
Các mẫu máu và huyết thanh chứa EDTA được thu thập hai lần một tuần. Nhiệt độ trực tràng được đo hai lần một tuần trước khi lấy mẫu động vật cũng như ở động vật có bất kỳ dấu hiệu lâm sàng nào sau khi tiêm phòng. Sự hiện diện của bộ gen ASFV trong máu được xác định bằng phương pháp realtime PCR .các mẫu huyết thanh đã được xét nghiệm tìm kháng thể bằng ELISA thương mại (IngenasaIngezim PPA Compac K3; Ingenasa, Madrid, Tây Ban Nha) và sử dụng xét nghiệm immunoperoxidase gián tiếp (IPT).
4. Bộ sưu tập mẫu
Vào cuối giai đoạn quan sát (54 ngày sau khi tiêm chủng), động vật sống sót được gây mê bằng cách tiêm bắp kết hợp thuốc gây tê của của tommeamine-zolazepam (Zoletil R 100mg / ml, Virbac, Pháp, liều đích 3 mg / kg) và medetomidine ( Virbac, Pháp, liều đích 0,05 mg / kg) ,sau đó được trung hòa bằng T61 tiêm tĩnh mạch.
Mổ khám nghiệm lợn chết được thực hiện để phát hiện sự hiện diện các tổn thương vĩ mô tương thích với ASF. 16 mẫu mô khác nhau (được liệt kê trong Bảng 1), bao gồm tất cả các hạch bạch huyết chính và các cơ quan nội tạng đích, được lấy từ mỗi cá thể và được thử nghiệm bằng phương pháp realtime PCR để phát hiện ASFV. Phân lập virus được thực hiện từ một tập hợp các mô, sử dụng quy trình đã được thiết lập.
5. Phân tích thống kê
Đường cong sinh tồn của Kaplan-Meier và test xếp hạng Mantel-Cox đã được sử dụng. Tương ứng, để tính xác suất tử vong và kiểm tra sự khác biệt đáng kể về tỷ lệ sống sót giữa các nhóm. Test MannWhitney U và mối tương quan Spearman đã được sử dụng để so sánh giá trị Ct từ real-time PCR giữa các nhóm thí nghiệm.
Dữ liệu được phân tích bằng SPSS 20 (IBM, Somar, NY, USA) tại mức ý nghĩa 0,05.
III. CÁC KẾT QUẢ
1. Kết quả trong thời gian tiêm chủng
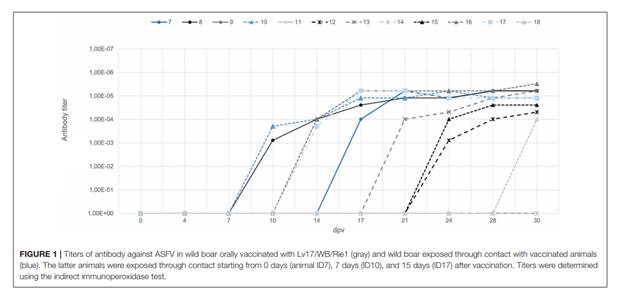
Trong thời gian tiêm chủng 30 ngày, 6/9 lợn rừng sử dụng văc-xin dương tính với kháng thể kháng ASFV trong các xét nghiệm ELISA và IPT bắt đầu từ 15 ± 3 ngày sau tiêm phòng (Hình 1). Tất cả ba con lợn rừng tiêm sau VContact cho thấy phản ứng kháng thể dương bắt đầu từ 14 ± 2 ngày sau tiếp xúc và chuẩn độ vẫn cao trong suốt thử nghiệm (Hình 1).
HÌNH 1. Chuẩn độ kháng thể kháng ASFV ở lợn rừng được dùng vắc-xin qua miệng Lv17 / WB / Rie1 (màu xám) và lợn rừng tiếp xúc với động vật đã được phòng (màu xanh da trời). Các động vật sau được tiếp xúc thông qua tiếp xúc bắt đầu từ 0 ngày (ID7 động vật), 7 ngày (ID10) và 15 ngày (ID17) sau khi dùng VX. Kết quả xác định bằng xét nghiệm immunoperoxidase gián tiếp.
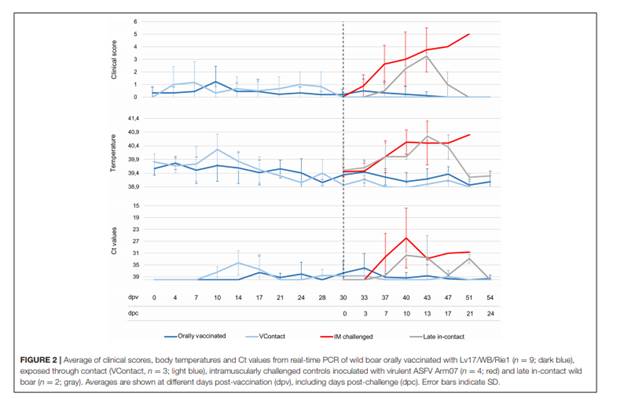
Những kết quả này chỉ ra rằng dùng đường uống Chủng Lv17 / WB / Rie1 có thể tạo ra đáp ứng miễn dịch ở lợn rừng. Không có dấu hiệu lâm sàng tương thích ASF được phát hiện ở những lợn được chủng ngừa với Lv17 / WB / Rie1. Phản ứng lâm sàng duy nhất phát hiện thấy nhiệt độ cơ thể tăng nhẹ lên 40,1-40,8◦C ở 7/9 động vật đã được phòng và ở 1/3 động vật tiêm sau VContact, kéo dài trung bình 3,5 ngày từ 4 đến 24 ngày sau khi tiêm chủng (Hình 2). Nhiễm virus đạt đỉnh vào những ngày khác nhau ở lợn. Trong 6/9 lợn được tiêm phòng và 2/3 lợn rừng VContact, kết quả realtime PCR cho thấy kết quả dương tính yếu (Ct = 33,02 ± 4,07) sau thời gian tiêm chủng 30 ngày. Nhiễm virut đỉnh điểm cho thấy một mối tương quan yếu với sự gia tăng nhẹ của thân nhiệt trong cơ thể (Hình 2).
HÌNH 2. Trung bình điểm lâm sàng, nhiệt độ cơ thể và giá trị Ct từ real-time PCR của lợn rừng được uống với Lv17 / WB / Rie1 (n = 9; màu xanh đậm),tiếp xúc thông qua tiếp xúc (VContact, n = 3; xanh nhạt), các biện pháp kiểm soát tiêm bắp được tiêm chủng với ASFV Arm07 cường độc (n = 4; đỏ) và lợn rừng tiếp xúc muộn (n = 2; màu xám). Trung bình được hiển thị tại các ngày khác nhau sau tiêm chủng (dpv), bao gồm cả những ngày sau thử thách (dpc). .
2. Kết quả sau thử thách
Đáp ứng miễn dịch ở lợn đã được tiêm phòng và lợn Vcontact có khả năng bảo vệ chống lại Arm07 cường độc. Sau khi tiếp xúc với mầm bệnh , 11/12 lợn được tiêm phòng và lợnVContact sống sót (92%). Hơn nữa, trong số đó không phát hiện bất kỳ dấu hiệu lâm sàng tương thích ASF hoặc tổn thương mô sau khi thử thách. Hai cá thể lợn uống văc-xin không có phản ứng kháng thể kháng ASFV hoặc tăng nhiệt độ cơ thể trong 30 ngày sau thời kỳ tiêm chủng phát triển đỉnh virut không liên tục sau thử thách nhưng lại có phản ứng kháng thể dương tính ở 3 và 7 ngày sau thử thách, tức là ở thời điểm tương ứng với 33 và 37 ngày sau khi tiêm phòng.
Ngược lại, tất cả các lợn nhận được thử thách tiêm bắp đã thể hiện các dấu hiệu lâm sàng nghiêm trọng tương thích với ASF (Hình 2). Những con vật này đã chết trong khoảng từ 7 đến 20 ngày hậu nhiễm trùng (Mantel-Cox, χ 2 = 18,88, 1 ngày.; p <0,001). Hai lợn tiếp xúc muộn có dấu hiệu lâm sàng tương tự như những lợn bị gây nhiễm virus cường độc (Hình 2), tuy nhiên lợn tiếp xúc muộn đã có phản ứng kháng thể ở 7 và 9 ngày sau thử thách, và sau đó đã phục hồi sức khỏe và sống sót. Trong số 9 lợn được phòng, có một con đã không qua khỏi thử thách và thể hiện dấu hiệu lâm sàng ASF tương tự như quan sát thấy trong thử thách tiêm bắp. Lợn rừng này không có phản ứng kháng thể.
Tất cả cá thể trong nhóm lợn gây nhiễm bởi virús cường độc đều phát hiện thấy kháng thể bắt đầu từ 6 -12 ngày sau khi thử thách và cho đến khi chết (Ct = 23,65 ± 4,68). Hai lợn tiếp xúc muộn cũng có kháng thể từ 6 – 11 ngày sau thử thách cho đến 21 ngày (Ct = 32,74 ± 1,11).4/8 động vật còn sống được dùng vắc-xin và một trong 3 con lợn rừng VContact lẻ tẻ có virut ở máu sau thử thách (Ct = 34,56 ± 1,60). Lợn được phòng nhưng không được bảo vệ bị nhiễm virus huyêt có giá trị Ct tương tự như lợn gây nhiễm virus cường độc (Ct= 26,31 ± 1,73).
Nói chung, giá trị viremia CT từ realtime PCR cao hơn đáng kể ở động vật sống sót so với động vật không được bảo vệ hoặc gây nhiễm cường độc. (Thử nghiệm Mann-Whitney U, Z = .82,84, p <0,01) (Hình 2). Các phân tích sau khám nghiệm cho thấy bệnh lý tương thích ASF chỉ có ở động vật chưa được tiêm phòng và gây nhiễm cường độc.
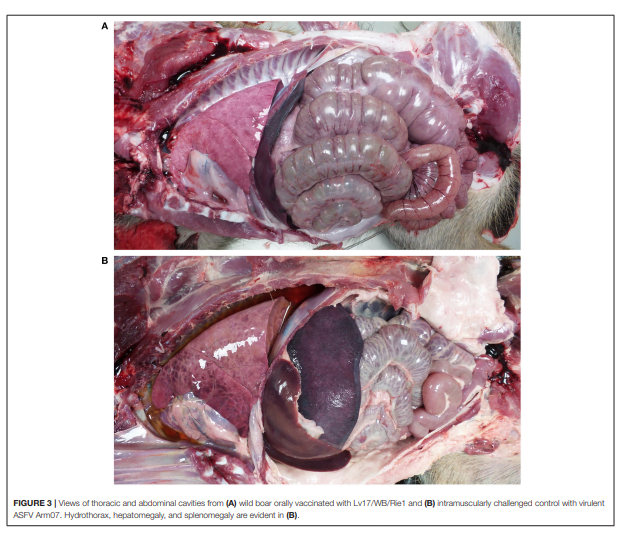
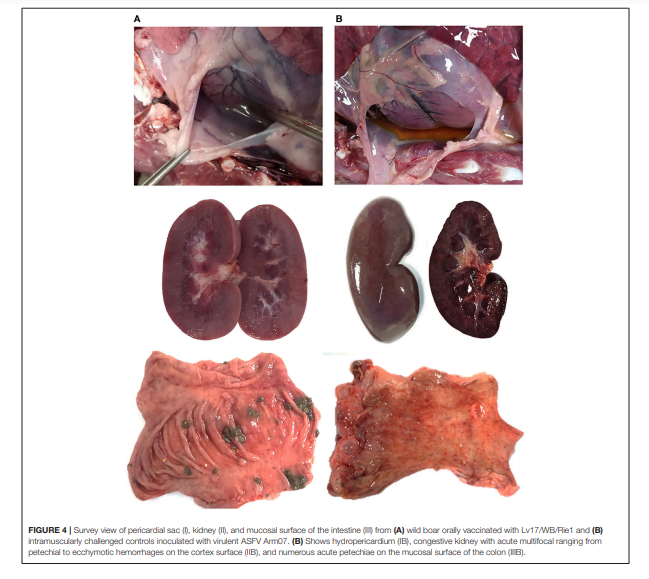
Những phát hiện chính là chất lỏng từ màu vàng đến hơi đỏ trong khoang bụng (cổ trướng), ở ngực(hydrothorax) và trong ngoại tâm mạc. (hydropericardium).Tắc nghẽn nói chung và xuất huyết khu trú đã được quan sát trên bề mặt phổi, lách (lách to), hạch bạch huyết (xuất huyết viêm hạch bạch huyết), thận, niêm mạc miệng (xuất huyết lan tỏa viêm bàng quang) và niêm mạc dạ dày (Hình 3, 4).
HÌNH 3. Hình ảnh khoang ngực và khoang bụng từ (A) lợn rừng được dùng VX với Lv17 / WB / Rie1 và (B) gây nhiễm cường độc chủng ASFV Arm07. Hydrothorax, hepatomegaly, và lách to được thấy rõ trong (B).
HÌNH 4. Quan sát Ngoại tâm mạc tim (I), thận (II) và bề mặt niêm mạc của ruột (III) từ lợn rừng (A) được dùng vắc-xin với Lv17 / WB / Rie1 và (B) gây nhiễm chủng cường độc với ASFV Arm07 . (B) Cho thấy hydropericardium (IB), thận sung huyết cấp , xuất huyết đến xuất huyết trên bề mặt vỏ thận (IIB) và nhiều xuất huyết cấp tính trên bề mặt niêm mạc của đại tràng (IIIB).
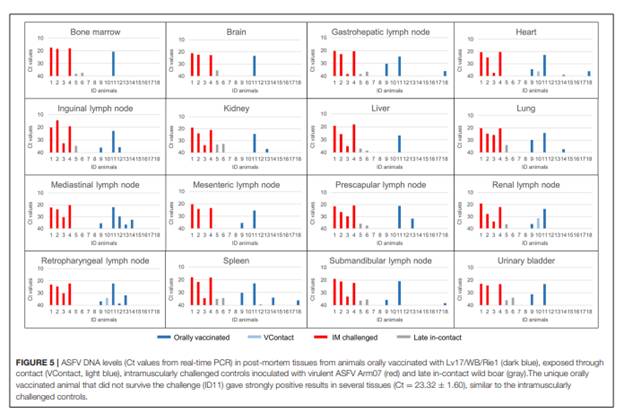
DNA bộ gen ASFV không được phát hiện ở bất kỳ trong số 16 các mô được phân tích ở ba trong số tám lợnđược dùng vắc-xin sống sót và hai trong số ba lợn VContact. Ở những lợn sống sót còn lại cho thấy kết quả PCR dương tính yếu (CT= 38,416 ± 1,16) trong 5 mô. ASFV phân lập được từ hai trong số 22 mô được phân tích từ những nhóm lợn này đó là hạch bạch huyết ở một cá thể lợn đã phòng VX và thận, hạch bạch huyết trong một cá thể lợn VContact. Những phân lập virus này là không xuất huyết. Hai con lợn rừng tiếp xúc muộn cho thấy Kết quả PCR dương tính yếu ở 9 hoặc 12 mô (Ct = 37,40 ± 0,43), trong đó ASFV xuất huyết chỉ được phân lập từ một hạch bẹn . Ngược lại, DNA virus được phát hiện ở hầu hết 16 mô được phân tích từ bốn lợn gây nhiễm cường độc,và mức độ cao hơn đáng kể (Ct = 21,59 ± 1,26) so với nhóm lợn sống sót (thử nghiệm Mann-Whitney U, Z = .652,65, p < 0,01). Trong trường hợp này, ASFV xuất huyết được phân lập từ một số mô. Theo cách tương tự, ở một lợn được dùng VX vẫn không được bảo vệ chống lại virus cường độc.
Kết quả PCR (Ct = 23,32 ± 1,60) trong tất cả 16 mô được thử nghiệm. Những kết quả được tóm tắt bằng mô và động vật trong( Hình 5).
Hình 5. Nồng độ DNA ASFV (giá trị Ct của real-time PCR) trong các mô của lợn chết – màu xanh đậm : lợn uống VX.; màu xanh nhạt: lợn Vcontact ; màu đỏ : lợn gây nhiễm chủng cường độc và màu xám : lợn tiếp xúc muộn.
Một lợn duy nhất được uống văc- xin không được bảo vệ sau khi thử thách cường độc cho kết quả dương tính mạnh với DNA của ASF ở một số mô (Ct =23,32+1,60) tương tự nhóm lợn gây nhiễm cường độc.
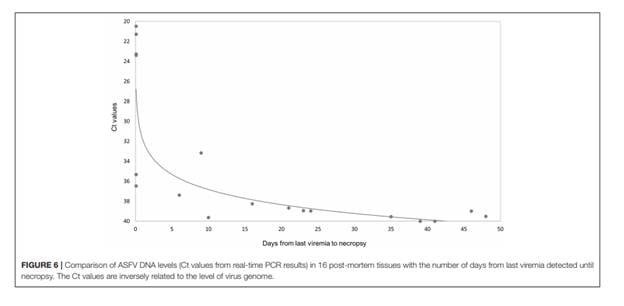
Đậm độ genome của virus tương quan nghịch với khoảng giữa lần cuối của virus huyêt được phát hiện và phân tích sau khi chết (xếp hạng Spearman tương quan, r = .80.853, p <0,001; Hình 6).
Hình 6. So sánh nồng độ DNA ASFV (giá trị Ct từ kết quả real-time-PCR ) trong 16 mô sau khilợn chết với số ngày kể từ lần nhiễm virut cuối cùng được phát hiện cho đến khi hoại tử. Các giá trị Ct có liên quan nghịch với mức độ bộ gen của virus.
IV. THẢO LUẬN
Trong điều kiện thí nghiệm, một virus ASF nhược độc tự nhiên được Phân lập (chủng Lv17 / WB / Rie1) (25) đã được thử nghiệm dưới dạng vắc-xin cho lợn rừng. Vì mục tiêu của vắc-xin này sẽ là phòng bệnh cho lợn rừng, trong lĩnh vực này, chúng tôi đã chú ý sử dụng vắc-xin nguyên mẫu như vậy bằng cách uống, chứng minh những kinh nghiệm thành công trong quá khứ (tức là, tiêm chủng chống lại sốt lợn cổ điển của lợn rừng ở Đức) (30).
Kết quả cho thấy chủng Lv17 / WB / Rie1 bảo vệ 92% động vật được uống vắc-xin và VContact chống lại thử thách bằng chủng cường độc Arm07 . Sự bảo vệ này không chỉ là sống sót mà còn không có Dấu hiệu lâm sàng tương thích ASF, không phát hiện biến đổi bệnh lý và virus trong các mô đích. Đây sẽ là Vắc-xin uống đầu tiên chống lại ASFV genotype II được thử nghiệm trong tự nhiên trên lợn rừng .Việc sử dụng vắc-xin này sẽ nhằm mục đích giảm số lượng lợn nhạy cảm, tăng miễn dịch đàn trong quần thể lợn rừng, và do đó, giảm Tỷ lệ mắc ASF.
Nghiên cứu in vivo hoàn chỉnh này cung cấp chi tiết về lâm sàng và phát hiện bệnh lý, đáp ứng kháng thể, thời kỳ nhiễm virut và Phát hiện AND virus ở 16 mô và cơ quan đích. Khi so sánh các kết quả này với các nghiên cứu thử nghiệm trước đây về vắc-xin thử nghiệm trên lợn nhà, hiệu quả bảo vệ chống lại thách thức độc lực là rõ rệt. Mặc dù kết quả thu được với số lượng không cân đối của các nhóm động vật, hiệu quả bảo vệ cao ở lợn rừng được quan sát trong nghiên cứu này là phù hợp với kết quả trước đó thu được với Lv17 / WB / Rie1 trong Hai con lợn nhà được tiêm bắp với cách ly này và bốn động vật tiếp xúc (25).
Do đó, chủng virus nhược độc tự nhiên này dường như có hiệu quả hơn các chủng khác đã được làm giảm độc bằng cách cấy chuyển liên tiếp trong các tế bào (31) hoặc bằng thao tác di truyền đã không gây ra miễn dịch chống lại virus gốc (32 cạn34). Theo nghĩa này, các nghiên cứu sâu hơn về bảo vệ chéo cần được tiến hành với Lv17 / WB / Rie1 đối với các chủng ASFV khác nhau , vì ASFV Arm07 cường độc được sử dụng làm thử thách trong nghiên cứu này cũng thuộc kiểu gen II.
Có nhiều nghiên cứu về việc thu được ASF V nhược độc Vắc xin bằng kỹ thuật di truyền, nó có thể được coi là một công cụ tiềm năng để cải thiện vắc-xin ứng cử viên , cho phép xóa các gen độc lực để tối đa hóa sự an toàn, nhưng cần nhớ rằng một số gen có vai trò bảo vệ thiết yếu cần phải được được duy trì. Như trường hợp của ASFV nhược độc Chủng NH / P68, nó bảo vệ toàn diện chống lại Arm07 , nhưng sau khi thao tác di truyền, các đột biến xóa đã được thử nghiệm cho đến nay không thể hiện khả năng bảo vệ hoàn toàn để chống lại thử thách với chủng virus độc lực,làm giảm hiệu quả của các ứng cử viên đó (23).
Quan sát của chúng tôi cho thấy ba con lợn rừng đã được tiêm chủng thông qua tiếp xúc chỉ ra rằng lợn được uống văc-xin có thể thải ra virus tương ứng. điều này cũng đã được mô tả cho ứng cử viên vắc-xin ASFV NH / P68 nhược độc (23), nó có thể giúp khuếch đại miễn dịch do tiêm chủng, giảm giá thành sản xuất và quản lý vắc-xin ở quy mô lớn.
Mặt khác, việc loại bỏ virus vắc-xin có nghĩa là những con lợn rừng phục hồi từ ASF hoạt động như hiện tượng mang virus và có nhiễm trùng dai dẳng (18, 19, 35, 36). Tuy nhiên, hai nghiên cứu dài hạn cho thấy sau khi phục hồi lâm sàng từ ASF, động vật bị nhiễm ASFV có độc lực vừa phải là có thể loại bỏ virus từ huyết thanh và mô và đã không truyền virut cho lợn bên cạnh (37, 38).
Trên thực tế, những con vật còn sống sót cho thấy hiệu giá kháng thể cao trong hơn 3 tháng sau khi nhiễm trùng ban đầu (37). Những kết quả này phù hợp với nghiên cứu của chúng tôi, ở thí nghiệm dùng vắc-xin cho uống và lợn rừng VContact duy trì chuẩn độ kháng thể cao (Hình 1). Trong khi viremia (Hình 2) và sự hiện diện của DNA virus trong các mô (Hình 6) giảm trong quá trình thí nghiệm, thậm chí sau khi thách thức cường độc.
Sự xác định của chúng tôi về phân lập Lv17 / WB / Rie1 chỉ từ hai mô của tất cả lợn uống vắc xin và lợn VContact vào cuối thí nghiệm cho thấy nguy cơ nhiễm trùng thấp sau giai đoạn nhiễm virut (25), mặc dù chúng đánh giá kết quả này là sơ bộ vì chúng tôi chưa cố gắng phân lập virus từ tất cả các mô có sẵn. Ngoài ra, nghiên cứu dài hạn là cần thiết để đánh giá khả năng của Lv17 / WB / Rie1 tồn tại và được truyền đi giữa các nhóm lợn rừng theo dõi.
Điều này đặc biệt quan trọng được đưa ra khi nghiên cứu nghiên cứu về khả năng của động vật đóng vai trò mang ASFV, có thể phụ thuộc vào chủng virus (18, 19, 35 cạn38). Các nghiên cứu sâu hơn cũng cần thiết để đánh giá sự an toàn của Lv17 / WB / Rie1 dưới dạng vắc-xin, chẳng hạn như để thiết lập những gì xảy ra khi động vật nhận được quá liều và để kiểm tra các tuyến phát tán virus theo thời gian (20, 39, 40).
Việc chúng tôi không có khả năng phát hiện DNA của ASFV bằng PCR trong ba trong số tám động vật còn sống được tiêm phòng và hai trong số ba Động vật VContact trong quá trình phân tích mô sau khi chết cho thấy rằng những con vật này đã loại bỏ hoàn toàn virus. Các động vật còn lại sống sót cho thấy PCR dương tính yếu kết quả chủ yếu ở các hạch bạch huyết sau màng phổi và dưới màng cứng ,điều đó chỉ ra rằng động vật đã không loại bỏ virus vắc-xin hoặc chúng có khả năng đã loại bỏ nó nhưng đã bị tái nhiễm bởi vi rút tồn tại trong các giai đoạn nhiễm virus trước đó . Virus này rất có thể là Lv17 / WB / Rie1 vì tất cả phân lập từ những động vật còn sống sót này là không xuất huyết.
Ngược lại, kiểm soát tiêm bắp chủng độc ASF và một lợn rừng không được bảo vệ cho thấy kết quả PCR dương tính mạnh trong tất cả các mô được phân tích (xem Hình 5) và DNA của virus là nhiều nhất có khả năng là chủng cường độc Arm07, vì các phân lập virus là tan máu. Những phát hiện này cho thấy virus Lv17 / WB / Rie1có thể được loại bỏ và không có khả năng truyền ngang một cách hiệu quả trong thời gian dài hạn, ít nhất là ở liều lượng và đường dùng trong nghiên cứu này.Phù hợp với ý tưởng này, mức độ DNA virus tương quan nghịch đảo với khoảng cách giữa nhiễm virus huyết và hoại tử lần cuối (Hình 6).
Phân tích của chúng tôi cho thấy rằng tiêm chủng đã giúp hai lợn rừngtiếp xúc muộn đã phục hồi sau khi nhiễm ASFV. Ban đầu Sau thử thách, nhiễm virut, nhiệt độ và dấu hiệu lâm sàng tương tự như động vật được thử thách tiêm bắp (Hình 2), và ASFV Arm07 virus huyết, thậm chí còn phân lâọ được ASFV từ hạch bạch huyết bẹn của một lợn tiếp xúc muộn.
Tuy nhiên hai lợn tiếp xúc muộn còn lại cho thấy phản ứng kháng thể cao ở 7 – 9 ngày sau thử thách và giảm dấu hiệu lâm sàng và nhiễm virut huyêt(Hình 2). Quan sát của chúng tôi thấy rằng cả hai lợn tiếp xúc muộn này đều có sự hiện diện của DNA ASFV trong các mô tương tự như lợn được uống vắc-xin và VContact sống sót (Hình 5). Như vậy, có khả năng phản ánh thực tế là động vật tiếp xúc muộn đã được tiếp xúc với cả hai chủng virus cùng một lúc. Trong thực tế, lâm sàng phục hồi và loại bỏ virus ở lợn tiếp xúc muộn thấy : Lv17 / WB / Rie1 có thể là một loại vắc-xin có hiệu quả cao, bảo vệ được lợn ngay cả khi có mặt chủng Arm07cường độc. Những kết quả này cần được xác minh và mở rộng trong các nghiên cứu tiếp theo về việc tiếp xúc với lợn ở cả 2 nhóm gây nhiễm cường độc và uống vắc-xin virus.
Theo hiểu biết của chúng tôi, đây là báo cáo đầu tiên về tiêm phòng thí nghiệm lợn rừng chống lại ASFV genotype II, và báo cáo đầu tiên về dùng văc-xin cho uống chống lại bất kỳ chủng ASFV nào trong heo rừng. Trong bối cảnh hiện tại của bệnh xuyên biên giới này,Một loại vắc-xin uống chống lại ASFV trong lợn rừng là rất cần thiết .
Do không có biện pháp kiểm soát có hiệu quả nào được áp dụng trong tự nhiên đến quần thể heo rừng (7, 13, 41). Nếu sự an toàn của Lv17 / WB / Rie1 dưới dạng vắc-xin có thể được thiết lập, thì nó có thể giúp giảm thiểu sự lây lan không kiểm soát của ASFV trên khắp châu Âu, tương tự như thành công trong việc ngăn chặn sự lây lan của Dịch tả lợn cổ điển.
Các nghiên cứu trong tương lai nên kiểm tra sự an toàn của vắc-xin lặp đi lặp lại hoặc quá liều, sự ổn định di truyền của virus văc-xin, sự ổn định của nó trong lĩnh vực gây đáp ứng miễn dịch bảo hộ dựa trên xét nghiệm huyết thanh học DIVA.
Tác giả: Jose A. Barasona 1*t,Carmina Gallardo2t,Estefanía Cadenas-Fernández1,
Cristina Jurado1, Belén Rivera1, Antonio Rodríguez-Bertos13,Marisa Arias2 and Jose M. Sánchez-Vizcaíno1
1 Cục Thú y, Khoa Thú y, Trung tâm Giám sát Sức khỏe VISAVET, Đại học Complutense Madrid, Madrid, Tây Ban Nha, 2 Phòng thí nghiệm Tham khảo Liên minh Châu Âu cho ASF Centro de Investigación en Sanidad Animal (I NIA-CISA), Madrid, Tây Ban Nha, 3 Phòng y và Phẫu thuật, Khoa Thú y, Đại học Complutense Madrid, Madrid, Tây Ban Nha
Biên dịch, tổng hợp: PGS TS Nguyễn Bá Hiên
– Nguyễn Thị Hồng Hạnh
- Tác động của thức ăn côn trùng và vi tảo đến chất lượng thịt gà
- Công nghệ phức hợp miễn dịch và tái tổ hợp trong nhà máy ấp
- 5 yếu tố cần xem xét trong một chương trình chăn nuôi heo không kháng sinh
- Bệnh bại liệt ở chó
- Biến động chất lượng vỏ trứng trong suốt chu kỳ đẻ trứng của gà
- Cải thiện hoạt động sản xuất thịt gia cầm không kháng sinh
- Đặc điểm sinh sản giống chó H’Mông cộc đuôi
- Lựa chọn đúng nguồn canxi cho loại thức ăn phù hợp
- Vịt to xác đẹp mã nhưng nhẹ cân
- Các dấu hiệu của bệnh cúm chó và cách điều trị
Tin mới nhất
T6,20/02/2026
- TP. Hồ Chí Minh: Tăng cường phòng chống dịch bệnh trên đàn vật nuôi dịp Tết Nguyên đán Bính Ngọ năm 2026
- Đón đọc Tạp chí Chăn nuôi Việt Nam số tháng 02 năm 2026
- Cấp bách phòng, chống dịch cúm gia cầm ở Hà Tĩnh
- Thái Nguyên: Lan tỏa mô hình ‘Ngân hàng gà đen’ ở Phong Quang
- Dịch tả lợn châu Phi bùng phát tại Hàn Quốc
- Giải pháp toàn diện cho dây chuyền sản xuất thức ăn thú cưng
- Vắc-xin AVAC ASF LIVE
- Kiểm soát bệnh đường ruột
- Khai thác sức mạnh từ thực vật
- Tập đoàn Hoàng Gia De Heus
- AChaupharm: Nấm phổi gia cầm, hiểm họa thầm lặng khi giao mùa
- Chuyên gia bàn giải pháp sử dụng kháng sinh có kiểm soát trong chăn nuôi
- Ngành sữa Việt Nam: Cơ hội “bứt phá” từ nội lực
- Dịch tả heo châu Phi: Hiện trạng và giải pháp kiểm soát hiệu quả (Phần 1)
- Bộ NN&MT mở đợt ‘truy quét’ việc lạm dụng chất kích tăng trưởng, tăng trọng
- Cargill rút khỏi ngành thức ăn thủy sản tại Việt Nam, đóng cửa nhà máy tại Đồng Tháp và Long An
- Chăn nuôi dê bền vững theo chuỗi giá trị: Chủ nhà hàng là mắt xích quan trọng
- Da khỏe, lông đẹp: Chiến lược dinh dưỡng hiệu quả cho heo con sau cai sữa
- Lo ngại bệnh than, Campuchia ngừng nhập một số sản phẩm từ Thái Lan
- Cạn tiền, một công ty tại Nam Phi phải tiêu hủy hơn 350.000 con gà

























































































 đã long trọng tổ chức Hội nghị tổng kết và tri ân khách hàng với chủ đề “Đồng hành dẫn lối tương lai”. Nhân dịp này, Ban Giám đốc công ty đã […]/0.jpg)











Bình luận mới nhất