[Tạp chí Chăn nuôi Việt Nam] – Porcine Circovirus tái tổ hợp dựa trên kiểu gien 2d tạo được kháng thể trung hòa chéo phổ rộng chống lại đa dạng kiểu gen và có khả năng bảo hộ chống lại PCV2d khi gây nhiễm kép với virus gây hội chứng hô hấp và sinh sản ở heo type 1 (PRRSV)
Kang,S.-J.;Bae,S.-M.;Lee, H.-J.; Jeong, Y.-J.; Lee, M.-A.; You, S.-H.; Lee, H.-S.; Hyun, B.-H.; Lee, N.; Cha, S.-H. Pathogens 2021, 10, 1145. https://doi.org/10.3390/ pathogens10091145.
Tóm tắt: Do tình trạng nhiễm PCV2d liên tục được ghi nhận ở các trang trại nuôi heo đã được tiêm vắc xin PCV2a hoặc 2d, chúng tôi đã cố gắng phát triển một loại vắc xin mới sử dụng protein capsid của PCV2d để nâng cao hiệu quả bảo hộ. Trong nghiên cứu này, các hạt vi rút tái tổ hợp (VLP) rPCV2a, rPCV2b và rPCV2d được tạo ra dựa trên các protein capsid của PCV2a, PCV2b và PCV2d phân lập từ thực địa. Thử nghiệm trung hòa chéo giữa kháng thể được tạo ra do VLPs và các chủng thực địa đã chứng minh khả năng trung hòa chéo phổ rộng của kháng thể do rPCV2d gây ra. Hiệu quả bảo hộ của rPCV2d với tư cách là một ứng cử viên vắc-xin đã được khảo sát ở heo thương phẩm bằng cách tiêm vắc-xin rPCV2d và gây nhiễm đơn PCV2d chủng thực địa, hoặc cùng lúc với chủng PCV2d và chủng PRRSV type 1 thực địa. IgG kháng PCV2d và kháng thể trung hòa đã được tạo ra ở mức độ cao sau 3 tuần tiêm chủng. Sau khi gây nhiễm, ADWG trung bình của nhóm được tiêm phòng cao hơn so với nhóm không được tiêm phòng. DNA của PCV2 không phát hiện được hoặc chỉ có một lượng thấp đáng kể (p <0,05) trong máu, nước bọt và mô của những con heo đã được tiêm phòng, khi so sánh với nhóm không được tiêm phòng. Hơn nữa, các bệnh tích đại thể và vi thể ở các mô đã giảm đáng kể (p <0,05) ở các nhóm được tiêm phòng. Do đó, nghiên cứu này cho thấy rằng, rPCV2d có thể rất hữu ích trong việc kiểm soát nhiều kiểu gen khác nhau trong thực địa.
Keywords: porcine circovirus type 2; Hạt virus tái tổ hợp; vaccine; trung hoà chéo
1. Giới thiệu
Porcine Circovirus type 2 (PCV2) là tác nhân gây bệnh chính cho một bệnh lâm sàng đa yếu tố (bệnh liên quan đến circovirus ở heo, porcine circovirus-associated disease – PCVAD), gây thiệt hại lớn về kinh tế trong ngành chăn nuôi heo. Ngoài ra, sự đồng nhiễm của PCV2 và các mầm bệnh khác (PRRSV, PPV và Mycoplasma hyopneumoniae) làm tăng mức độ nghiêm trọng lâm sàng của PCVAD, có lẽ thông qua tác dụng hiệp đồng, có thể điều chỉnh sự nhân lên hoặc loại trừ PCV2 thông qua sự thay đổi sản xuất cytokine [1–3].
Theo các công bố gần đây, PCV2 được phát hiện ở khoảng 87% số trang trại nuôi heo trên toàn quốc, và kiểu gen chính của nó là PCV2d [4]. Ngoài ra, kiểu gen PCV2d chiếm khoảng 95% PCV2 được phân lập ở Hàn Quốc từ năm 2016 đến năm 2020 [5]. Sự chuyển đổi kiểu gen từ PCV2a và 2b sang PCV2d đang xảy ra trên toàn thế giới [4,6,7]. Hầu hết các vắc xin PCV2 thương mại hiện nay được sản xuất bằng cách sử dụng protein capsid kiểu gen PCV2a làm thành phần kháng nguyên. Đã có báo cáo rằng vắc xin PCV2a hiện tại bảo vệ chéo hiệu quả các trường hợp heo nhiễm PCV2d [8,9]. Tuy nhiên, PCV2 không được loại bỏ hoàn toàn khỏi máu và các mô, mặc dù các vắc xin này có thể làm giảm các triệu chứng lâm sàng. Trong nghiên cứu trước đây của chúng tôi, kháng huyết thanh từ heo được gây miễn dịch với PCV2a cho thấy khả năng trung hòa khác nhau chống lại các dòng PCV2d có nguồn gốc di truyền khác nhau [5]. Hiệu quả không ổn định của vắc xin chống lại PCV2 đang lưu hành gần đây đã tăng lên trên thực địa [10–13]. Ngoài ra, vi-rút và tải lượng vi-rút còn sót lại trong mô của những con heo đã được tiêm phòng, kết quả của việc bảo vệ một phần do hiệu quả vắc-xin thấp, có thể gây ra thiệt hại nghiêm trọng về kinh tế trong ngành chăn nuôi heo thông qua việc giảm trọng lượng trung bình hàng ngày và chậm xuất chuồng [14]. Nhìn chung, có bằng chứng cho thấy rằng, các vắc xin dựa trên PCV2a hiện tại có thể phải được thay thế để phù hợp với sự tiến hóa di truyền của các chủng PCV2 phân lập.
Các vắc xin PCV2 hiện tại được sản xuất hoặc là với các hạt virus tái tổ hợp dựa trên ORF2 hoặc nguyên vi rút bất hoạt để làm kháng nguyên, và được sử dụng hiệu quả để kiểm soát PCVAD. Xét đến tính an toàn và hiệu quả của PCV2-VLPs, VLPs gần đây đã được xem là ứng cử viên vắc xin tiểu đơn vị thế hệ tiếp theo. VLP là một hạt siêu phân tử giống như virut tự nhiên nhưng không có bộ gen của virut, được hình thành sau quá trình lắp ráp các protein cấu trúc đơn phân, dưới dạng các protein tái tổ hợp trong vật chủ [15,16]. Vì VLP không lây nhiễm và có thể tạo ra các phản ứng miễn dịch dịch thể và qua trung gian tế bào [17,18], công nghệ dựa trên VLP sản xuất vắc xin là một phương pháp tốt để thiết kế các chất mang yếu tố kháng nguyên ngoại lai và đã được sử dụng rộng rãi trong sản xuất thuốc thú y. và vắc xin VLP ở người [19–21]. Trong dữ liệu sơ bộ của chúng tôi, chủng PCV2d (QIA244) không bị trung hoà bởi kháng huyết thanh có nguồn gốc từ việc chủng ngừa dựa trên PCV2a, trong khi kháng huyết thanh thu được được khi gây miễn dịch với chủng QIA244 có thể trung hoà hiệu quả các phân lập PCV2a, 2b và 2d thực địa theo xét nghiệm trung hòa chéo in vitro. Do đó, trong nghiên cứu này, chúng tôi đã sản xuất vắc xin PCV2d-VLP chứa protein tái tổ hợp dựa theo ORF2 của QIA244, và đánh giá hiệu quả của vaccine trong điều kiện in vitro và in vivo.
2. Kết quả
2.1. Sản xuất hạt virus (VLPs) biểu hiện bởi hệ thống Baculovirus
Các tế bào Sf9 được gây nhiễm các chủng baculovirus tái tổ hợp rAc-OP-PCV2a-ORF2, rAc-OP-PCV2b-ORF2 và rAc-OP-PCV2d-ORF2, để sản xuất các VLP biểu hiện PCV2a-ORF2, PCV2b-ORF2 và PCV2d-ORF2, tương ứng. Khối lượng phân tử của các protein toàn phần PCV2a-ORF2, PCV2b-ORF2 và PCV2d-ORF2 xấp xỉ 27 kDa, thể hiện dưới dạng dải sáng chiếm ưu thế trong gel SDS-PAGE điện di dịch ly giải tế bào (Hình 1a) và được xác nhận bằng kỹ thuật lai protein sử dụng kháng thể đa dòng kháng PCV2. Các protein PCV2a-ORF2, PCV2b-ORF2 và PCV2d-ORF2 biểu hiện trong tế bào côn trùng tự lắp ráp để tạo thành VLP, và protein PCV2-ORF2 tinh khiết được phân tích bằng kính hiển vi điện tử truyền qua (Transmission Electron Microscopy – TEM) để xác nhận sự lắp ráp đúng của PCV2a-VLPs (Hình 1b), PCV2b -VLPs (Hình 1c) và PCV2d-VLPs (Hình 1d). Các VLP có kích thước xấp xỉ 17 nm và có dạng đối xứng 20 mặt.
2.2. Sự trung hoà chéo của kháng huyết thanh tạo ra bởi các hạt VLP
Để đánh giá khả năng trung hòa chéo của các kháng thể do VLP gây ra, kháng huyết thanh của chuột và heo được chủng ngừa bằng VLPs của PCV2a (rPCV2a), 2b (rPCV2b) và 2d (rPCV2d) đã được cho phản ứng chéo với các chủng PCV2, bao gồm các kiểu gien PCV2a (QIA215), PCV2b (QIA418) và PCV2d (QIA169 và QIA244) (Bảng 1). Nhìn chung, ba kháng huyết thanh thu được ở chuột và heo do tiêm rPCV2 cho thấy hiệu giá NA với QIA215, QIA418 và QIA169 cao hơn đáng kể (1075 ± 400 đến 6553 ± 1003 ở chuột và 1024 ± 512 đến 5802 ± 2389 ở heo) so với QIA244 (58 ± 19 đến 819 ± 307 ở chuột và 75 ± 28 đến 725 ± 299 ở heo). Hơn nữa, không có sự khác biệt thống kê về hiệu giá NA của ba kháng huyết thanh do rPCV2 gây ra đối với QIA215, QIA418 và QIA169, mặc dù hiệu giá NA trung bình của kháng huyết thanh rPCV2d cao hơn so với các kháng huyết thanh rPCV2 khác. Về mặt trung hòa giữa QIA244 và ba kháng huyết thanh do rPCV2 tạo ra, hiệu giá NA của kháng huyết thanh rPCV2d chống lại QIA244 (819 ± 307 ở chuột và 725 ± 299 ở heo) cao hơn đáng kể so với kháng huyết thanh rPCV2a (64 ± 18 ở chuột và 75 ± 28 ở heo) và kháng huyết thanh rPCV2b (58 ± 19 ở chuột và 149 ± 56 ở heo) chống lại QIA244.
Bảng 1. Hiệu giá kháng thể trung hoà (trung bình ± SE) of VLPs (rPCV2a, rPCV2b và rPCV2d) ở chuột (n = 5) và heo (n = 3).
2.3. Hiệu quả bảo hộ của việc tiêm vaccine rPCV2d ở heo
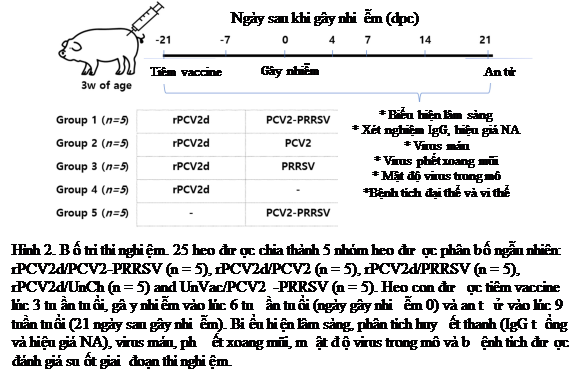
Bố trí nghiên cứu được minh hoạ trong hình 2 và động vật thí nghiệm được mô tả trong phần nguyên vật liệu và phương pháp.
2.3.1. Biểu hiện lâm sàng và ADWG
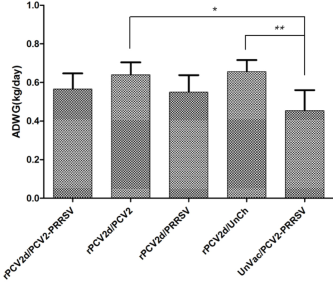
Các dấu hiệu lâm sàng, bao gồm nhiệt độ trực tràng, tiêu chảy, mệt mỏi và xù lông, không được quan sát thấy ở bất kỳ nhóm nào được tiêm vắc-xin trong 21 ngày sau khi thử thách gây nhiễm, trong khi nhóm không được tiêm vaccine UnVac/PCV2/PRRSV lại có các dấu hiệu lâm sàng. Như thể hiện trong Hình 3, ADWG của nhóm UnVac/PCV2/PRRSV (0,45 ± 0,11 kg/ngày) thấp hơn một chút so với nhóm rPCV2d/PCV2/PRRSV (0,57 ± 0,08 kg/ngày) và rPCV2d/PRRSV (0,55 ± 0,09 kg/ngày), bị gây nhiễm PRRSV, trong khi thấp hơn đáng kể (p < 0,05) so với nhóm rPCV2d/PCV2 (0,64 ± 0,06 kg/ngày) và rPCV2d/UnCh (0,65 ± 0,06 kg/ngày) ) (Hình 3).
Hình 3, Tăng trọng trung bình ngày (ADWG). Trọng lượng heo được đánh giá mỗi tuần cho đến 21 ngày sau khi gây nhiễm và ADWG (kg/day) được tính trong thời gian từ 0 đến 21 ngày sau gây nhiễm. Khác biệt có ý nghĩa được minh hoạ * p < 0.05 và ** p < 0.01.
2.3.2. Nồng độ PCV2 và PRRSV trong máu, dịch xoang mũi và mô
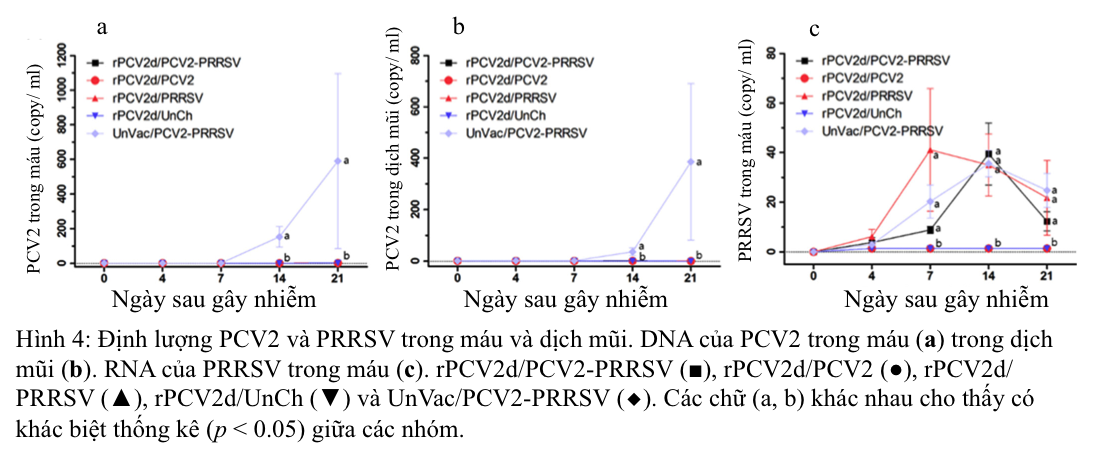
DNA của PCV2 trong máu và dịch xoang mũi được phát hiện với nồng độ đáng kể (153 ± 45 đến 590 ± 391 bản sao trong máu và 37 ± 12 đến 386 ± 236 bản sao trong dịch mũi) đối với nhóm UnVac/PCV2/PRRSV, từ ngày 14 đến ngày 21 sau khi gây nhiễm, trong khi DNA của PCV2 không phát hiện được hoặc hầu như không phát hiện được ở heo của tất cả các nhóm được tiêm phòng (Hình 4a, b). RNA của PRRSV chỉ được phát hiện trong các nhóm bị gây nhiễm PRRSV (rVac/PCV2/PRRSV, rVac/PRRSV và UnVac/PCV2/PRRSV) (Hình 4c). Nồng độ RNA PRRSV đã tăng từ ngày thứ 7 sau gây nhiễm (9 ± 0,6 lên 41 ± 5,2 bản sao) trong máu, đạt cực đại ở ngày thứ 14 sau gây nhiễm (35 ± 2,6 đến 39 ± 3,2 bản sao) và nhanh chóng giảm xuống ở ngày thứ 21 sau gây nhiễm (12 ± 1,5 đến 25 ± 8,3 bản sao). Trong các mô, ở ngày 21 sau khi gây nhiễm, DNA của PCV2 ở mức ngưỡng giới hạn hoặc không phát hiện được trong các mô ở tất cả các nhóm được tiêm vắc-xin rPCV2d (Bảng 2), trong khi lại phát hiện được trong nhóm UnVac/PCV2/PRRSV (5237 ± 3380 ở phổi, 19.720 ± 11.795 ở amidan, 11.172 ± 8150 ở hạch màng treo ruột và 3742 ± 2488 ở hạch bẹn). RNA của PRRSV phát hiện được trong các mô (102 ± 12 đến 155 ± 16 ở phổi, 117 ± 62 đến 319 ± 48 ở amidan, 2,9 ± 0,0 đến 26± 3,2 ở hạch màng treo ruột và 45 ± 2,8 đến 113 ± 1,6 ở hạch bẹn) của tất cả các nhóm.
2.3.3. Huyết thanh học PCV2 và PRRSV
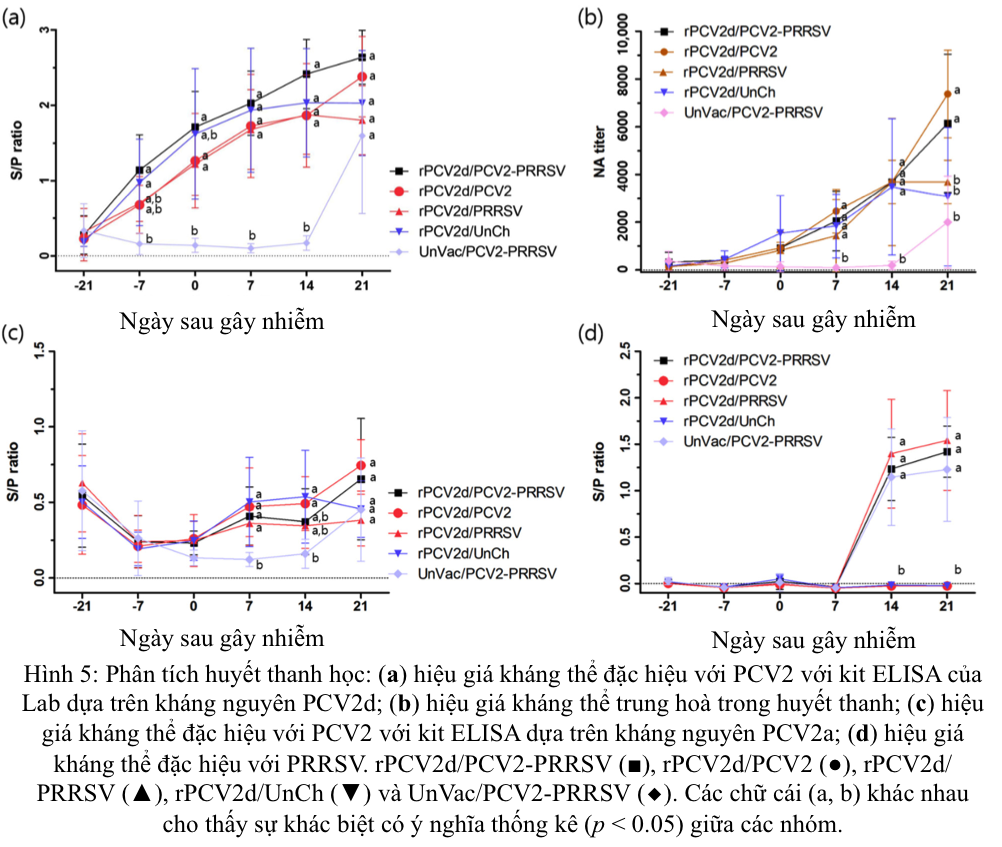
Sử dụng xét nghiệm ELISA do Lab sản xuất, được phủ kháng nguyên PCV2d, đã ghi nhận sự chuyển đổi huyết thanh ở các nhóm được tiêm vắc-xin rPCV2d (rPCV2d/PCV2/PRRSV, rPCV2d/PCV2, rPCV2d/PRRSV và rPCV2d/UnCh) từ ngày thứ 7 trước khi gây nhiễm (Hình 5a). Hiệu giá NA từ ngày thứ 7 sau khi gây nhiễm cao hơn đáng kể (p < 0,05) ở các nhóm được tiêm chủng (1434 ± 675 đến 2458 ± 410) so với nhóm UnVac/PCV2/PRRSV (93 ± 46) (Hình 5b). Hơn nữa, ở ngày 21 sau gây nhiễm, hiệu giá VN ở các nhóm rPCV2d/PCV2/PRRSV và rPCV2d/PCV2 đã tăng lên 6144 ± 1295 và 7373 ± 819, tương ứng, trong khi hiệu giá NA ở các nhóm rPCV2d/PRRSV và rPCV2d/UnCh lại giảm từ ngày 14 sau gây nhiễm. Hiệu giá NA cho nhóm UnVac/PCV/PRRSV tăng lên 1997 ± 866 ở ngày 21 sau gây nhiễm. Khi sử dụng xét nghiệm ELISA thương mại, chuyển đổi huyết thanh được quan sát thấy từ ngày 7 sau gây nhiễm, với mức tăng nhẹ cho đến ngày 21 sau gây nhiễm ở các nhóm rPCV2d/PCV2/PRRSV và rPCV2d/PCV2 (Hình 5c). Mặt khác, nhóm rPCV2d/PRRSV và rPCV2d/UnCh duy trì mức hiệu giá gần như âm cho đến ngày 21 sau gây nhiễm và nhóm UnVac/PCV2/PRRSV chuyển huyết thanh dương tính ở ngày 21 sau gây nhiễm. Sự chuyển đổi huyết thanh đặc hiệu với PRRSV được ghi nhận ở tất cả các nhóm bị nhiễm PRRSV từ ngày 14 sau gây nhiễm (Hình 5d).
2.3.4 Bệnh tích đại thể và vi thể
Bệnh tích đại thể và vi thể đã được cho điểm và kết quả được tóm tắt trong Bảng 3. Điểm số của bệnh tích đại thể (hạch phổi và bẹn) ở nhóm rPCV2d/PCV2/PRRSV (0,4 ± 0,6 và 0,0 ± 0,0), rPCV2d/PCV2 (0,2 ± 0,5 và 0,2 ± 0,5) và rPCV2d/UnCh (0,0 ± 0,0 và 0,0 ± 0,0) thấp hơn đáng kể (p < 0,05) so với nhóm UnVac/PCV2/PRRSV (1,2 ± 0,5 và 1,2 ± 0,5). Các bệnh tích chủ yếu được quan sát thấy ở phổi, chẳng hạn như tái tạo tế bào lympho quanh phế quản và viêm phổi kẽ (Hình S1, Tài liệu bổ sung). Điểm bệnh tích vi thể (phổi và hạch bẹn) ở nhóm
rPCV2d/PCV2/PRRSV (0,8 ± 0,5 và 0,0 ± 0,0), rPCV2d/PCV2 (0,0 ± 0,0 và 0,0 ± 0,0), rPCV2d/PRRSV (0,3 ± 0,5 và 0,0 ± 0,0) và nhóm rPCV2d/UnCh (0,0 ± 0,0 và 0,0 ± 0,0) thấp hơn đáng kể (p < 0,05) so với nhóm UnVac/PCV2/PRRSV (1,4 ± 0,6 và 0,8 ± 0,5). Theo phân tích mô bệnh học, bệnh tích không ghi nhận được ở amidan và cả hai hạch bạch huyết của bất kỳ nhóm nào được tiêm vắc-xin, trong khi sự mất tế bào lympho nhẹ hoặc trung bình và sự tăng sinh đại thực bào đã được quan sát thấy ở nhóm UnVac/PCV2/PRRSV (Hình S2, Tài liệu bổ sung ). Điểm số bệnh tích đại thể và vi thể của các mô khác không có sự khác biệt giữa các nhóm.
3. Thảo luận
Mặc dù đã tiêm phòng PCV2 rộng rãi trên toàn quốc, PCV2 vẫn lưu hành mạnh trong các trang trại heo, dẫn đến thiệt hại kinh tế liên tục do PCVAD gây ra trên thực tế. Các nghiên cứu trước đây đã báo cáo rằng, mặc dù vắc-xin dựa trên PCV2a thương mại được coi là bảo vệ lâm sàng chống lại kiểu gen PCV2d [9,22], các chủng PCV2d thường được phân lập từ heo bị bệnh lâm sàng ở các trang trại heo đã được tiêm vắc-xin PCV2, có thể là do vắc-xin không bảo hộ đủ [7 ,12]. Đặc điểm di truyền/kháng nguyên gần đây của các chủng phân lập từ các trang trại bị ảnh hưởng bởi PCVAD cho thấy rằng, hơn 90% các chủng phân lập PCV2 ở Hàn Quốc có kiểu gen PCV2d và phản ứng chéo trung hòa thấp giữa các kiểu gen hoặc chủng PCV2 [5 ]. Có ý kiến cho rằng, mức độ trung hòa chéo thấp có thể giải thích cho sự lưu hành mạnh của PCV2 và xảy ra sự cố vắc xin ở các trang trại heo đã được tiêm phòng. Khả năng trung hòa chéo giữa các chủng phân lập trên thực địa đã được nghiên cứu bằng cách sử dụng kháng huyết thanh của chuột và heo được tiêm rVLP (rPCV2a, rPCV2b và rPCV2d) như một thành phần hoạt tính của vắc-xin PCV2. Trong số các VLP được thử nghiệm, PCV2d VLP cho thấy có khả năng tạo phản ứng chéo rộng với một số chủng phân lập trên thực địa và cho hiệu quả bảo vệ đối với gây nhiễm thử thách PCV2d ở heo.
Liên quan đến khả năng nhận dạng của kháng huyết thanh do các VLP tạo ra, hiệu giá NA của tất cả các kháng huyết thanh đối với chủng QIA244 đều thấp hơn đáng kể so với các chủng virus khác, trong khi hiệu giá trung hòa của kháng huyết thanh do rPCV2d tạo ra cao hơn đáng kể so với các VLP khác đối với tất cả các chủng phân lập, bao gồm cả QIA244. VLP dựa trên QIA244 (rPCV2d) đã cho thấy sự nhận diện rộng rãi các kiểu gen hoặc chủng PCV2 khác nhau, điều này đã được báo cáo trong một nghiên cứu trước đây, cho thấy kháng huyết thanh do chủng kiểu gen PCV2d bất hoạt, QIA244, có khả năng trung hòa rộng [5]. Do đó, việc sử dụng rPCV2d như một ứng viên vắc-xin dự kiến sẽ mang lại hiệu quả bảo vệ tốt hơn so với các vắc-xin dựa trên PCV2a hiện tại. Mặt khác, điều bất ngờ là hiệu giá kháng thể trung hòa của kháng huyết thanh rPCV2d đối với QIA244 (819 ± 307 ở chuột và 725 ± 299 ở heo) thấp hơn đáng kể so với các chủng phân lập thực địa khác (dao động từ 4915 ± 1389 đến 6553 ± 1003 ở chuột và 2816 ± 1280 đến 5802 ± 2389 ở heo), bất kể kiểu gen nào, điều này đáng được quan tâm trong các nghiên cứu tiếp theo.
Để đánh giá hiệu quả của vắc-xin sử dụng rPCV2d, trước tiên chúng tôi phải thiết lập mô hình lây nhiễm kép PCV2 và PRRSV để tái tạo PCVAD ở heo trong điều kiện thí nghiệm, bởi vì để gây ra biểu hiện điển hình của bệnh liên quan đến PCV2 ở heo con thương phẩm sinh ra từ heo nái được tiêm phòng vắc xin PCV2 cần phải gây nhiễm cùng lúc PRRSV, PPV và Mycoplasma hyopneumoniae [1,2,3]. Trong mối quan hệ giữa PCV2 và PRRSV, PCV2 không ảnh hưởng đến sự sao chép của PRRSV hoặc bệnh tích do PRRSV gây ra, trong khi đó PRRSV lại làm tăng lượng DNA của PCV2 trong huyết thanh và mô của heo đồng nhiễm [23,24,25]. Trong nghiên cứu hiện tại, chúng tôi khẳng định được rằng gây nhiễm chủng PCV2 phân lập kết hợp với PRRSV týp 1 đã khiến cho lượng virus trong máu và tải lượng cao virus PCV2 trong các mô, cũng như gia tăng bệnh tích phổi, so với gây nhiễm đơn lẻ hoặc PCV2 hoặc PRRSV. Tuy nhiên, khả năng gây bệnh của PRRSV không bị ảnh hưởng bởi sự đồng nhiễm của PCV2, điều này cho thấy sự lây nhiễm kép của PCV2 và PRRSV có thể được sử dụng để đánh giá hiệu quả của vắc-xin PCV2 mới được phát triển.
Việc tiêm rPCV2d đã tạo ra một lượng IgG đặc hiệu với PCV2 và các kháng thể trung hòa ở heo ở mức cao đáng kể. Để đánh giá hiệu giá IgG đặc hiệu với PCV2d, xét nghiệm ELISA sử dụng các VLP của PCV2d đã được phát triển để khắc phục sự đánh giá miễn dịch không chính xác, có thể do sự khác biệt kháng nguyên của các VLP (nghiên cứu này) và các chủng phân lập thực địa [5]. So với bộ ELISA thương mại, bộ ELISA của Lab đã xác nhận sự kích hoạt rõ ràng và sự phát triển theo thời gian hiệu giá IgG đặc hiệu với PCV2 ở heo được tiêm phòng, trong khi bộ ELISA thương mại không phát hiện được các phản ứng miễn dịch khi tiêm vắc xin PCV2d VLP, như được thể hiện trong hình 5c. Kết quả âm tính do sự khác biệt về kháng nguyên ELISA cho thấy rằng, bộ ELISA thương mại hiện tại có thể phải được đánh giá lại về hiệu quả chẩn đoán hoặc được phát triển mới phù hợp với sự thay đổi kháng nguyên của các kiểu gen mới nổi hiện nay.
Nhìn chung, việc giảm các dấu hiệu lâm sàng và bệnh tích bệnh lý do nhiễm PCV2 có mối tương quan thuận với việc giảm lượng virus trong máu và tải lượng virus trong các mô [9,22]. Vì tải lượng PCV2 trong máu dẫn đến hiệu suất tăng trưởng kém, do đó làm chậm quá trình biến dưỡng [14], và vì mức hiệu giá NA có mối tương quan rõ với việc giảm tải lượng PCV2 [26], việc tiêm vaccine để tạo ra phản ứng miễn dịch mạnh hơn và có khả năng nhận diện rộng sẽ là cần thiết để bảo vệ hiệu quả hơn trong việc chống lại các chủng phân lập trên thực địa.
Vào 3 tuần sau khi tiêm vaccine (ngày 0 sau khi gây nhiễm), hiệu giá NA (819 ± 338 đến 1536 ± 706) khác biệt không đáng kể giữa các nhóm được tiêm vaccine, trong khi có sự gia tăng mạnh mẽ ở các nhóm được tiêm vaccine và gây nhiễm do phản ứng nhớ sau khi gây nhiễm. Ngay cả khi hiệu giá kháng thể trung hoà sau khi tiêm vắc-xin của các nghiên cứu trước đây [27,28] dao động từ 1:32 đến 1:64 trong vòng 42–75 ngày sau khi tiêm vắc-xin, thì có thể không phù hợp khi cho rằng hiệu giá kháng thể trung hoà do tiêm vắc-xin trong nghiên cứu này là cao hơn đáng kể so với các nghiên cứu khác, vì mức độ miễn dịch đối với PCV2 dường như khác biệt đáng kể tùy theo chất thử và quy trình được sử dụng để đánh giá. Tuy nhiên, do hiệu giá kháng thể trung hoà trung bình được tạo ra khi tiêm vaccine CircoFlex (Boehringer Ingelheim, Ingelheim, Đức), một trong những loại vắc-xin thương mại, là 1:16 đối với QIA244 và 1:516-1024 đối với PCV2 kiểu gen khác trong nghiên cứu so sánh về khả năng miễn dịch của heo, Bảng 1 (dữ liệu không được hiển thị), có thể cho rằng vắc-xin được phát triển tạo ra hiệu giá kháng thể trung hoà ở mức cao hơn so với vắc-xin thương mại.
Trong nghiên cứu này, việc tiêm vắc-xin rPCV2d đã chứng minh khả năng bảo vệ cao chống lại sự lây nhiễm PCV2. Việc tiêm vắc-xin rPCV2d làm giảm đáng kể sự bài thải và tải lượng của chủng vi-rút gây nhiễm QIA244 trong máu và dịch mũi, như nghiên cứu đã ghi nhận lượng DNA của PCV2 ở mức thấp tương tự như ở nhóm không bị gây nhiễm (rPCV2d/UnCh). Một số nghiên cứu trước đây đã báo cáo rằng, ở heo sau tiêm vaccine vẫn có sự bài thải vi rút trong nước bọt và lượng vi rút đáng kể trong máu [27,29]. Hơn nữa, tiêm vắc-xin rPCV2d bảo vệ hoàn toàn heo khỏi các bệnh tích bệnh lý đại thể hoặc vi thể ở phổi và hạch bẹn. Điều thú vị là, mặc dù không có bệnh tích bệnh lý rõ ràng ở hạch màng treo ruột và amidan trong nhóm UnVac/PCV2/PRRSV, DNA của virus PCV2 trong các mô của những heo này lại ở mức độ cao hơn so với hạch ở phổi và bẹn có bệnh tích bệnh lý. Sự không tương quan giữa mức độ lượng DNA của virus và sự hiện diện của bệnh tích bệnh lý không phù hợp với các nghiên cứu trước đây [14,30] và cần được làm rõ hơn trong tương lai. Dù rằng có các bệnh tích bệnh lý được ghi nhận, việc tiêm vắc-xin rPCV2d đã làm giảm rõ rệt tải lượng vi-rút trong tất cả các mô được nghiên cứu trong nghiên cứu này. Điều quan trọng là, các giá trị ADWG trung bình của các nhóm được tiêm phòng cao hơn so với các giá trị của nhóm không được tiêm phòng, cho thấy rằng việc tiêm phòng rPCV2d sẽ hữu ích trong việc chống lại PCV2 và đảm bảo năng suất vật nuôi. Trong khi đó, phân tích dữ liệu được quan sát giữa các nhóm nhiễm PRRSV týp 1 cho thấy khác biệt không có ý nghĩa thống kê, có nghĩa là các nhóm này bị ảnh hưởng bởi độc lực của PRRSV, thể hiện ở mức tải lượng vi rút PRRSV trong máu và mô tương tự với các nhóm nhiễm PRRSV. Vì vậy, có thể cho rằng độc lực của PRRSV được sử dụng trong mô hình gây nhiễm kép nên được kiểm soát cẩn thận hơn trong quá trình đánh giá hiệu quả bảo vệ của vắc xin PCV2. Nói chung, nghiên cứu này đã chứng minh rằng rPCV2d có tiềm năng lớn như một loại vắc-xin mới để bảo vệ heo khỏi PCVAD, gây ra bởi các chủng PCV2 có kiểu gen khác nhau hiện đang phổ biến (PCV2a, PCV2b và PCV2d), với khả năng phòng bệnh được nâng cao.
4. Nguyên vật liệu và phương pháp
4.1 Virus và tế bào
Các chủng PCV2 phân lập từ các trang trại heo bị ảnh hưởng bởi PCVAD, như được mô tả trong một nghiên cứu trước đây [5]. Các chủng thực địa PCV2 bao gồm QIA215 (PCV2a), QIA418 (PCV2b), QIA169 và QIA244 (PCV2d) được nhân lên trong các tế bào PK15 không nhiễm PCV được nuôi cấy trong DMEM bổ sung 5% FBS (Gibco-BRL, NY, USA) và 1% penicillin và streptomycin (Millipore, MA, USA). PRRSV týp 1 được phân lập từ heo con có vấn đề về hô hấp và nhân lên trong tế bào MARC-145 được nuôi cấy trong môi trường RPMI-1640 bổ sung 10% FBS, 1% penicillin và streptomycin.
PCV2d và PRRSV týp 1 được chuẩn độ tương ứng trên các tế bào PK15 và MARC-145 bốn lần. Tóm lại, dịch trên bề mặt môi trường nuôi cấy virus được thu nhận và pha loãng liên tục (log10) và được cho vào từng môi trường tế bào và ủ trong 2 giờ, sau đó được rửa hai lần bằng dung dịch PBS. Sau 24 giờ, hiệu giá vi rút PCV2 và PRRSV được xác định bằng phương pháp nhuộm miễn dịch huỳnh quang với kháng thể đơn dòng đặc hiệu PCV2 và dựa theo tác động gây độc tế bào, sử dụng phương pháp Spearman–Karber TCID50.
4.2 Sản xuất VLP với hệ thống biểu hiện Baculovirus (BES)
Tế bào Sf9 được nuôi cấy trong bình Erlenmeyer (Corning, NY, USA) ở 27°C trong môi trường không có huyết thanh Sf-900III (Invitrogen, Waltham, CA, USA) để nhân giống baculovirus. Các VLP dựa trên ORF2 được sản xuất trong tế bào Sf9 sử dụng BES. Gen ORF2 của chủng QIA244, kiểu gien PCV2d, có độ dài đầy đủ, được tổng hợp bằng cách tối ưu hóa các codon để biểu hiện trong tế bào côn trùng, trước khi được tạo dòng trong vectơ chuyển gien pOET1. Để tạo ra baculovirus tái tổ hợp, các tế bào Sf9 đã được cấy chuyển đồng thời plasmid vector chuyển gien và DNA FlashBAC (Oxford Expression Technologies, Oxford, UK). Các baculovirus đã chuyển gien được đặt tên là rAc-OP-PCV2d-ORF2. Vi-rút được nhân giống liên tiếp trong các tế bào Sf9, sau đó được thu hoạch và chuẩn độ bằng phương pháp đếm khóm phân giải (plaque). Ngoài ra, rAc-OP-PCV2a-ORF2 và rAc-OP-PCV2b-ORF2, sử dụng các trình tự ORF2 của PCV2a (NCBI số KF871067.1) và PCV2b (NCBI số AY099500.1), tương ứng, được sản xuất theo cùng một quy trình. Các VLP PCV2 được tạo ra trong các tế bào Sf9 với mật độ tế bào là 1 × 106 tế bào/mL với bội số nhiễm virus (MOI) là 0,5, với các baculovirus tái tổ hợp, rPCV2a, rPCV2b và rPCV2d, tương ứng cho các kiểu gen ORF2a, ORF2b và ORF2d.
4.3 Phân tích các VLP PCV2
Sau khi các tế bào Sf9 được gây nhiễm, phần nổi của dịch nuôi cấy tế bào được phân tách bằng 12% SDS-PAGE. Số lượng VLP PCV2 được tạo ra trong các tế bào Sf9 được đo bằng máy quét mật độ sử dụng phần mềm ImageQuant TL (GE Healthcare, Chicago, IL, USA), trước khi so sánh với đường chuẩn albumin huyết thanh bò (BSA). Phân tích kính hiển vi điện tử truyền qua được thực hiện bằng các phương pháp truyền thống. Tóm lại, các VLP PCV2 được hấp phụ trên lưới đồng phủ carbon trong 3 phút ở nhiệt độ phòng (RT). Lưới được nhuộm màu âm bản với dung dịch uranyl axetat 2% (w/v). Ảnh hiển vi được ghi lại bằng kính hiển vi điện tử truyền qua (Hitachi H7100FA, Tokyo, Nhật Bản).
4.4 Phản ứng trung hoà chéo của kháng huyết thanh với rPCV2a, rPCV2b và rPCV2d
Để chủng ngừa cho chuột, 20 con chuột cái BALB/c (6 tuần tuổi) không có mầm bệnh đặc biệt (SPF) đã được mua và nuôi trong cơ sở nuôi nhốt động vật. Chuột được phân bổ ngẫu nhiên vào bốn nhóm: rPCV2a (n = 5), rPCV2b (n = 5), nhóm rPCV2d (n = 5) và nhóm không được tiêm chủng (n = 5). Chuột được tiêm chủng trong màng bụng bằng 200 µL dịch chứa 20 µg rPCV2a, hoặc rPCV2b hoặc rPCV2d VLP, cùng với chất bổ trợ carbomer. Đối với heo, 12 con heo lai thương mại (3 tuần tuổi) không có kháng nguyên và kháng thể PCV2 đã được tiêm bắp với 1 mL dung dịch chứa 200 µg rPCV2a (n = 3), hoặc rPCV2b (n = 3) hoặc rPCV2d (n = 3) và không có VLP (n = 3) làm đối chứng âm. Thực hiện tiêm nhắc cho chuột và heo được tiến hành ở 2 tuần sau khi chủng ngừa lần đầu. Lúc 4 tuần sau khi chủng ngừa lần đầu, các mẫu huyết thanh được thu thập từ chuột và heo của tất cả các nhóm thử nghiệm để đo hiệu giá kháng thể trung hòa chống lại PCV2a (QIA215), PCV2b (QIA418) và PCV2d (QIA169 và QIA244).
4.5 Hiệu quả bảo hộ ở heo được tiêm vaccine rPCV2d
4.5.1 Nghiên cứu ở heo
Heo con lai thương phẩm 3 tuần tuổi sạch bệnh Mycoplasma spp. và PRRSV, với hiệu giá kháng thể IgG đặc hiệu với PCV2 âm tính hoặc thấp và âm tính với PCV2, đã được sử dụng cho nghiên cứu. Hiệu quả bảo vệ của vắc-xin tái tổ hợp (rPCV2d) được đánh giá bằng thách thức nhiễm kép PCV2 và PRRSV. Như được minh hoạ trong Hình 2, 25 con heo được chia ngẫu nhiên thành 5 nhóm (mỗi nhóm 5 con), được tiêm phòng lúc 3 tuần tuổi và gây nhiễm lúc 6 tuần tuổi (Hình 2). Trong số bốn nhóm được tiêm vắc-xin rPCV2d, nhóm đầu tiên (rPCV2d/PCV2/PRRSV) được gây nhiễm với PCV2 và PRRSV, nhóm thứ hai (rPCV2d/PCV2) được gây nhiễm với PCV2, nhóm thứ ba (rPCV2d/PRRSV) được gây nhiễm với PRRSV và nhóm thứ tư (rPCV2d/UnCh) không bị gây nhiễm. Nhóm còn lại (UnVac/PCV2/PRRSV) chưa được tiêm vaccine và được gây nhiễm PCV2 và PRRSV. Chủng PCV2 được sử dụng gây nhiễm là QIA244, kiểu gen PCV2d, có trình tự ORF2 tương đồng với rPCV2d, trong khi PRRSV là PRRSV type I có khả năng gây bệnh từ thấp đến trung bình, trong nghiên cứu sơ bộ của chúng tôi (dữ liệu không được hiển thị). Hiệu giá của hai loại virus gây nhiễm là 105 TCID50/mL. Mỗi heo con được gây nhiễm theo đường mũi 3 mL PCV2 và 3 mL PRRSV đối với gây nhiễm kép; và 3 mL PCV2 và 3 mL PBS; hoặc 3 mL PRRSV và 3 mL PBS đối với gây nhiễm trùng đơn. Tất cả heo được tiêu hủy ở 21 ngày sau khi gây nhiễm bằng cách tiêm tĩnh mạch natri pentobarbital và giật điện. Các phương pháp liên quan đến các nghiên cứu đã được phê duyệt bởi Ủy ban Chăm sóc và Sử dụng Động vật KBNP.
4.5.2 Dấu hiệu lâm sàng và tăng trọng trung bình ngày
Sau khi gây nhiễm, các dấu hiệu lâm sàng của tất cả heo được quan sát hàng ngày, bao gồm nhiệt độ trực tràng, rối loạn hô hấp hoặc tiêu hóa, ho và khập khiễng. Trọng lượng cơ thể được xác định hàng tuần cho đến 21 ngày sau gây nhiễm và ADWG (kg/ngày) được tính theo trọng lượng cơ thể trong khoảng từ 0 đến 21 ngày sau gây nhiễm.
4.5.3 Định lượng PCV2 và PRRSV
Axit nucleic tổng số (DNA và RNA) của PCV2 và PRRSV được chiết xuất với bộ kit thương mại (DNeasy Blood & Tissue Kit, Qiagen, Hilden, Đức), tiếp theo là RT-PCR định lượng sử dụng LightCycler 480 II (Roche Diagnostics, Mannheim, Đức) để định lượng số lượng bản sao DNA hoặc RNA trong huyết thanh, dịch mũi và mô. Các bản sao DNA của PCV2 trong các mẫu được phát hiện bằng cách sử dụng TB GreenTM Premix Ex TaqTM (TaKaRa, Kyoto, Nhật Bản), với cặp mồi chuyên biệt được thiết lập cho gen ORF2 của PCV2: đoạn mồi xuôi 5′–CACGGATATTGTAGTCCTGGTCG–3′ và đoạn mồi ngược 5′ –CGCACCTTCGGATATACT–3′. PCR được thực hiện theo các điều kiện sau: biến tính ở 95°C trong 5 giây, sau đó ủ ở 64°C trong 10 giây trong tối đa 45 chu kỳ. Các bản sao RNA của PRRSV được phát hiện bằng cách sử dụng Bộ QuantiTect Probe PCR (Qiagen, Hilden, Đức) với các đoạn mồi đặc hiệu cho ORF7 như sau: đoạn mồi xuôi 5′–GTACAATGATAAAGTCCCAGCAC–3, đoạn mồi ngược 5′– GAATCAAGCGCACTGTATGAGC–3 và đoạn dò 5′–CCTCTGCTTGCAATCGATCCAGAC–3′. Sau khi có được đường cong chuẩn của mồi, tiến hành khuếch đại gen mục tiêu. Các đường cong bắt cặp của các sản phẩm khuếch đại đã được phân tích để xác minh tính đặc hiệu của PCR, các mẫu dương tính là những mẫu có ngưỡng chu kỳ (Ct) <35 chu kỳ.
4.5.4 Phân tích ELISA
Mức kháng thể trong huyết thanh chống lại PCV2 và PRRSV được đo bằng cách sử dụng các bộ xét nghiệm ELISA thương mại như sau: PCV2 (VDpro PCV2 Ab kit, Median diagnostics, Seoul, Korea) và PRRSV (IDEXX PRRS X3 Ab test, IDEXX Laboratories Inc. Westbrook, ME, USA ). Mật độ quang (OD) của xét nghiệm ELISA đối với PCV2 và PRRSV được đọc tương ứng ở bước sóng 450 nm và 650 nm, theo hướng dẫn của nhà sản xuất. Các mẫu huyết thanh được coi là dương tính với PCV2 và PRRSV nếu tỷ số S/P > 0,4. Đối với ELISA xét nghiệm kháng thể PCV2d của Lab, tất cả các mẫu được phân tích theo mô tả của Blanchard và đồng nghiệp [31]. Tóm lại, các đĩa 96 giếng được phủ protein capsid PCV2d tinh khiết và được phong toả bằng 1% BSA trong PBS. Sau đó, thêm vào 100 µL/giếng huyết thanh đã pha loãng ở tỷ lệ 1:1600 trong PBS và ủ ở nhiệt độ phòng trong 30 phút. Sau ba bước rửa với PBS chứa 0,5% Tween-20 (PBS-T), kháng thể IgG dê kháng heo đánh dấu peroxidase peroxidase (Abcam, Cambridge, MA, USA) ở độ pha loãng cuối cùng được thêm vào và sau đó được ủ tiếp ở nhiệt độ phòng trong 30 phút. Các giếng được rửa ba lần và phản ứng được kết thúc bằng 100 µL dung dịch tetramethyl benzidine (Thermo, Waltham, MA, USA). Sau khi ủ trong 15 phút ở nhiệt độ phòng, OD được đọc ở bước sóng 450nm.
4.5.5 Xét nghiệm trung hoà virus
Xét nghiệm trung hòa tập trung huỳnh quang (fluorescent focus neutralization – FFN) được thực hiện bằng cách sử dụng từng chủng PCV2 như được mô tả bởi Meerts và đồng nghiệp [32]. Tóm lại, 100 µL liều 200 TCID50 PCV2 được ủ trong 1 giờ ở 37°C với 100 µL kháng huyết thanh thu thập từ các nhóm thử nghiệm được pha loãng nối tiếp. Sau khi ủ, huyễn dịch này được cho thêm 5 × 103 tế bào PK15 phân phối trong bốn giếng của một đĩa 96 giếng. Sau 2 giờ ở 37°C, các tế bào nuôi cấy được rửa hai lần trong dung dịch PBS 1X và môi trường mới được thêm vào. Ở 3 ngày sau gây nhiễm, các tế bào được cố định trong 80% acetone (Merck Millipore, MA, USA) trong nước cất. Các tế bào PK15 bị nhiễm PCV2 được nhuộm như mô tả trước đây [5]. Hiệu giá kháng thể trung hòa (NA) được tính toán bằng xét nghiệm trung hòa vi rút 90% (VNT90), được định nghĩa là độ pha loãng huyết thanh cao nhất giúp bảo vệ hơn 90% tế bào khỏi nhiễm PCV2.
4.5.6 Bệnh tích đại thể và vi thể
Tất cả heo đã được giết nhân đạo bằng cách tiêm tĩnh mạch natri pentobarbital và cho điện giật lúc 9 tuần tuổi (21 ngày sau gây nhiễm). Các bệnh tích đại thể và vi thể được phân tích hình thái học như mô tả trước đây [33]. Các bệnh tích đại thể của phổi, amidan, hạch màng treo ruột và hạch bẹn được cho điểm là 0 (bình thường), 1 (nhẹ), 2 (trung bình) hoặc 3 (nặng). Mô phổi, amidan, hạch màng treo ruột và hạch bẹn được thu thập khi khám tử, được cố định trong 10% formalin đệm trung tính và được xử lý theo quy trình thường quy để kiểm tra mô học. Các bệnh tích vi thể ở các nhóm điều trị được đánh giá bởi một nhà nghiên cứu bệnh học thú y. Mô phổi được cho điểm dựa trên sự hiện diện và mức độ nghiêm trọng của viêm phổi kẽ, được cho điểm là 0 (không có bệnh tích), 1 (viêm phổi kẽ nhẹ), 2 (viêm phổi kẽ trung bình) hoặc 3 (viêm phổi kẽ nặng). Các mô bạch huyết, bao gồm amidan và các hạch bạch huyết, được đánh giá theo sự hiện diện của sự suy giảm bạch huyết với thanh điểm 0 (bình thường), 1 (nhẹ), 2 (trung bình) hoặc 3 (nặng).
4.6 Xử lý thống kê
Các kết quả được biểu thị bằng giá trị trung bình ± sai số chuẩn (SE) với ba lần thử nghiệm (n = 3). Ý nghĩa thống kê được xác định bằng phần mềm GraphPad Prism 7 (GraphPad Software, Inc., San Diego, CA, USA) với phân tích phương sai một chiều (ANOVA) và thử nghiệm so sánh nhiều lần của Dunnett để so sánh các nhóm. Giá trị p <0,05 được coi là có ý nghĩa thống kê.
Lời cảm ơn
Chúng tôi xin cảm ơn You-Chan Bae đã sẳn lòng hỗ trợ phân tích các mẫu mô trong khám tử.
Thông tin bổ sung
Các thông tin sau đây có sẵn trực tuyến tại https://www.mdpi.com/article/10.3390/pathogens10091145/s1: Hình S1, quan sát đại thể các bệnh tích phổi; Hình S2, quan sát vi thể các bệnh tích ở phổi, amiđan, hạch màng treo ruột và hạch bẹn.
- Doanh nghiệp nuôi heo kỳ vọng hưởng lợi cuối năm?
- TP.HCM: Hỗ trợ tối đa 100 triệu đồng cho cơ sở chăn nuôi để xử lý chất thải
- Hội Chăn nuôi Việt Nam: Củng cố vị thế, đồng hành cùng ngành chăn nuôi trong giai đoạn mới
- Haid Group ký kết dự án nhà máy thức ăn chăn nuôi 300.000 tấn/năm tại Phú Thọ
- Khát vọng đưa giống bò sữa Việt Nam vươn nhóm năng suất dẫn đầu thế giới
- Bộ Nông nghiệp và Môi trường công bố thủ tục hành chính nội bộ sửa đổi, bổ sung trong lĩnh vực thú y, thủy sản
- Dabaco khẳng định chiến lược tăng trưởng bền vững tại Hội nghị Gặp mặt Nhà đầu tư 2025
- NAPHAVET tuyển dụng vị trí Bác sỹ Thú y
- Giá heo hơi hôm nay 15-12: Đồng loạt tăng giá trên cả nước
- Siba Group lập liên doanh với đơn vị Trung Quốc xây nhà máy cung ứng chăn nuôi
Tin mới nhất
T2,15/12/2025
- Doanh nghiệp nuôi heo kỳ vọng hưởng lợi cuối năm?
- TP.HCM: Hỗ trợ tối đa 100 triệu đồng cho cơ sở chăn nuôi để xử lý chất thải
- Hội Chăn nuôi Việt Nam: Củng cố vị thế, đồng hành cùng ngành chăn nuôi trong giai đoạn mới
- Haid Group ký kết dự án nhà máy thức ăn chăn nuôi 300.000 tấn/năm tại Phú Thọ
- Khát vọng đưa giống bò sữa Việt Nam vươn nhóm năng suất dẫn đầu thế giới
- Bộ Nông nghiệp và Môi trường công bố thủ tục hành chính nội bộ sửa đổi, bổ sung trong lĩnh vực thú y, thủy sản
- Dabaco khẳng định chiến lược tăng trưởng bền vững tại Hội nghị Gặp mặt Nhà đầu tư 2025
- NAPHAVET tuyển dụng vị trí Bác sỹ Thú y
- Giá heo hơi hôm nay 15-12: Đồng loạt tăng giá trên cả nước
- Siba Group lập liên doanh với đơn vị Trung Quốc xây nhà máy cung ứng chăn nuôi
- AChaupharm: Nấm phổi gia cầm, hiểm họa thầm lặng khi giao mùa
- Chuyên gia bàn giải pháp sử dụng kháng sinh có kiểm soát trong chăn nuôi
- Ngành sữa Việt Nam: Cơ hội “bứt phá” từ nội lực
- Dịch tả heo châu Phi: Hiện trạng và giải pháp kiểm soát hiệu quả (Phần 1)
- Bộ NN&MT mở đợt ‘truy quét’ việc lạm dụng chất kích tăng trưởng, tăng trọng
- Cargill rút khỏi ngành thức ăn thủy sản tại Việt Nam, đóng cửa nhà máy tại Đồng Tháp và Long An
- Chăn nuôi dê bền vững theo chuỗi giá trị: Chủ nhà hàng là mắt xích quan trọng
- Da khỏe, lông đẹp: Chiến lược dinh dưỡng hiệu quả cho heo con sau cai sữa
- Lo ngại bệnh than, Campuchia ngừng nhập một số sản phẩm từ Thái Lan
- Cạn tiền, một công ty tại Nam Phi phải tiêu hủy hơn 350.000 con gà





































































































Bình luận mới nhất