GIỚI THIỆU
Tình trạng bệnh đặc hữu “endemic” của Dịch tả heo Châu Phi (ASF) được báo cáo ở nhiều khu vực trên thế giới, cũng được xem như dịch nội vùng, làm cho việc kiểm soát, phòng bệnh và loại trừ bệnh rất khó khăn. Sự lưu hành kéo dài của mầm bệnh tạo ra bức tranh dịch tễ phức tạp, mặc dù ở các khu vực “dịch địa phương” của ASF heo mắc bệnh có biểu hiện lâm sàng không đặc trưng (tỷ lệ chết thấp) và một số trường hợp ở thể cận lâm sàng hay nhiễm trùng mãn tính. Nguyên nhân có thể do miễn dịch trên heo mắc bệnh còn sống sót qua ổ dịch tăng dần qua thời gian, sự thay đổi độc lực của mầm bệnh, giống heo địa phương ít nhạy cảm hơn và sự can thiệp phòng trị của con người.
Ở Việt Nam, sự biến chuyển nhanh tình trạng dịch tễ cũng được ghi nhận khá rõ khi so sánh các đặc điểm dịch tễ giữa giai đoạn đầu virus ASF xâm nhập năm 2019 với các năm sau đó. Như vậy, viễn cảnh của ASF và tương lai đàn heo của Việt Nam ra sao là một sự quan tâm lớn. Chính vì thế, mục tiêu của bài báo này là tổng hợp bức tranh dịch chuyển dịch tễ của ASF từ dạng đặc trưng “epidemic” qua tình trạng “endemic”, từ đó đề xuất giải pháp phòng bệnh và tái đàn phù hợp.
SỰ XÂM NHẬP VÀ TÁC ĐỘNG CỦA ASF
Ca bệnh ASF đầu tiên, được xác định ở một nông hộ tại Hưng Yên, một tỉnh phía bắc Việt nam, vào ngày 19 tháng 02 năm 2019. Những triệu chứng lâm sàng và bệnh tích mổ khám tại các ổ dịch ASF này tương tự với mô tả ở Trung Quốc và Georgia. Trong cùng thời điểm, các ổ dịch ASF tiếp tục được báo cáo tại 5 tỉnh thành miền Bắc khác. Trong 3/2019, có 17 tỉnh thành miền bắc và bắc trung bộ ghi nhận thêm ca bệnh ASF. Đến 4/2019, thủ phủ chăn nuôi heo tại phía nam Việt Nam (Đồng Nai province) xuất hiện các ổ dịch ASF. Dịch nhanh chóng đạt đỉnh vào 5/2019, báo cáo ghi nhận thêm 24/63 tỉnh thành khắp các vùng miền cả nước có dịch ASF. Ninh Thuận, tỉnh có đàn heo nhỏ nhất cả nước, thuộc Nam Trung Bộ là tỉnh cuối cùng báo cáo xuất hiện dịch vào 8/2019. Theo báo cáo của Cục Thú Y Việt Nam (11/12/2019), ASF đã xảy ra tại 8553/10614 xã thuộc 667/705 huyện trong 63/63 tỉnh (thành phố) với tổng số heo tiêu hủy gần 6.0 triệu con, chiếm khoảng 9% tổng số đầu heo của cả nước.
Dịch bệnh ASF cùng biến động thị trường đã làm giảm mạnh số trại nuôi heo và có sự dịch chuyển về quy mô chăn nuôi. Theo số liệu báo cáo 2021, tỷ lệ trại heo quy mô lớn (>300 heo) đã gia tăng đáng kể so với trại heo quy mô nhỏ. Theo ước lượng thống kê, tỷ trọng số trại heo quy mô vừa (>100 heo) và lớn (>1500 heo) là 35,6%; và thêm vào đó số lượng đàn heo quy mô rất lớn (5,8 triệu heo) thuộc 16 doanh nghiệp chăn nuôi trong nước và FDI, chiếm tỷ lệ 6,1% tổng đàn lợn của cả nước. Khi ASF lan rộng khắp đất nước, các hộ chăn nuôi và trại chăn nuôi gia đình có tỷ lệ phát dịch bệnh cao nhất. Trong khi, các trại chăn nuôi lớn an toàn dịch bệnh hơn do có sự hiểu biết, đầu tư và thực hiện an toàn sinh học tốt hơn.
Các chỉ số về đầu heo và sản lượng thịt heo tại Việt Nam đều cho thấy một sự giảm sâu vào năm đầu tiên ASF xuất hiện. Mặc dù trước đó, tổng đàn heo đã tăng thêm hơn 1,7 triệu heo trong giai đoạn từ 2010 – 2016 để đạt hơn 28 triệu con. Cuộc khủng hoảng mang tên ASF năm 2019 đã làm suy giảm nghiêm trọng số lượng đầu heo xuống còn khoảng 19,6 triệu con. Thực sự ấn tượng, hai năm sau dịch bệnh (cuối năm 2021), tổng đàn heo đã dần phục hồi để tăng lên 23,2 triệu con. Số lượng đầu nái cũng tương tự biến động theo xu hướng của tổng lượng đàn heo tại Việt Nam. Năm 2016, số lượng heo nái (4,2 triệu con) là cao nhất trong lịch sử chăn nuôi; giảm xuống còn 2,7 triệu con vào năm 2019, và tăng lên trở lại đến mức gần 3,3 triệu con vào năm 2021. Tương tự, sản lượng thịt xuất chuồng giảm rất mạnh xuống mức 3,3 triệu tấn sau khi ASF nổ ra năm 2019, do sự tiêu hủy đàn heo bệnh trên diện rộng. Sản lượng thịt xuất chuồng đã tăng lên mức gần 3,6 triệu tấn hơn một năm sau đó, và xu hướng tăng dần trở lại ở các năm tiếp theo. Nhìn chung, ASF đã tác động rất lớn vào ngành chăn nuôi heo ở các khía cạnh khác nhau từ năm 2019 đến nay, và sự thích ứng của ngành chăn nuôi thời kỳ hậu ASF diễn ra rất nhanh; góp phần kiến tạo tư duy chăn nuôi heo hướng đến các mô hình giảm thiểu rủi ro của dịch bệnh và bền vững hơn.
Bảng 1. Số lượng hộ chăn nuôi theo quy mô qua các năm khảo sát ở nước ta
(Source: GSO, 2022)
|
Thời điểm khảo sát |
Tổng số |
Quy mô nhỏ |
Quy mô lớn |
||||
|
1-9 con |
10-29 con |
30-99 con |
100-299 con |
>300 con |
|||
|
1.7.2016 |
Số lượng (hộ) |
3.479.597 |
2.647.412 |
632.213 |
171.915 |
23.601 |
4.456 |
|
Tỉ lệ (%) |
100 |
76,08 |
18,17 |
4,94 |
0,68 |
0,13 |
|
|
1.1.2019 |
Số lượng (hộ) |
2.962.573 |
2.463.561 |
399.112 |
84.437 |
10.418 |
5.045 |
|
Tỉ lệ (%) |
100 |
83,16 |
13,47 |
2,85 |
0,35 |
0,17 |
|
|
1.1.2020 |
Số lượng (hộ) |
1.817.053 |
1.534.859 |
230.801 |
41.656 |
5.882 |
3.855 |
|
Tỉ lệ (%) |
100 |
84,47 |
12,7 |
2,29 |
0,32 |
0,21 |
|
|
1.1.2021 |
Số lượng (hộ) |
2.052.837 |
1.713.103 |
279.085 |
49.962 |
6.380 |
4.307 |
|
Tỉ lệ (%) |
100 |
83,45 |
13,6 |
2,43 |
0,31 |
0,21 |
|
TÌNH TRẠNG ĐẶC HỮU VÀ ĐẶC TRƯNG LÂY TRUYỀN CỦA ASF
Ngay khi xuất hiện lần đầu tiên, ASF lây lan nhanh chóng ở phạm vi toàn quốc và đạt đỉnh với tốc độ nhanh chưa từng ghi nhận trong lịch sử của ASF trước đây. Chỉ sau vài tháng, ASF đã đạt đỉnh dịch với 1724 ổ dịch được ghi nhận trên cả nước (tháng 5/2019). Các tháng sau đó, tần số ổ dịch giảm dần và đạt mức thấp (34 ổ dịch) vào 12/2019. Thời gian ASF đạt đỉnh trên đàn heo ngắn hơn so đàn heo của Trung Quốc; tuy nhiên tỷ lệ chết (tiêu hủy) do ASF trên heo ở nước ta cao hơn Trung Quốc và các nước Asia khác. Chiến lược tiêu hủy toàn bộ đàn khi phát hiện heo dương tính với ASFV làm tăng cao nhanh chóng tổng số heo chết (tiêu hủy). Năm 2020 và 2021, số lượng ổ dịch được công bố theo từng tháng giảm thấp, rải rác cho thấy ASF dịch chuyển sang trạng thái bệnh đặc hữu (endemic). Số ổ dịch theo từng tháng trong năm 2020 và 2021 dao động khoảng 46-460 ổ dịch/tháng và 56-600 ổ dịch/tháng, tương ứng. Các số liệu ghi nhận của các phòng xét nghiệm bệnh heo cho thấy nhiều trại heo có sự đồng nhiễm của virus ASF cùng với các mầm bệnh hiện hữu khác trên các heo thịt mắc biểu hiện viêm phổi nặng, viêm khớp gia tăng nhưng không thể hiện lâm sàng đặc trưng ổ dịch cấp tính. Tình trạng endemic hình thành là đặc trưng phản ánh nhiều hiện trạng như quần thể có sức đề kháng nhất định (heo nhiễm sống sót qua ổ dịch tăng dần qua thời gian), sự thay đổi độc lực của mầm bệnh, sự can thiệp phòng trị của con người và bên cạnh đó là các biện pháp an toàn sinh học chăn nuôi được thực thi tốt hơn, cũng như kinh nghiệm của người chăn nuôi được nâng cao qua các đợt dịch bệnh.
Khả năng gây bệnh và sự bài xuất mầm bệnh ASF sau gây nhiễm được mô tả trong nghiên cứu của Lee et al. (2021). 10 heo thương phẩm được gây bệnh chủng virus ASF Việt Nam, ủ bệnh trong 3,7 ± 0,5 ngày sau gây nhiễm và chết trong 5-8 ngày sau gây nhiễm. ASFV được phát hiện trong máu lúc 2,2 ± 0,8 ngày sau gây nhiễm. Tuy nhiên, virus ASF được phát hiện trong mẫu ngoáy trực tràng, mũi và miệng lúc 3,1 ± 0,7, 3,2 ± 0,4 và 3,6 ± 0,7 ngày sau gây nhiễm, tương ứng. Hơn nữa, DNA của virus ASF được phát hiện ở hàm lượng thấp hơn trong mẫu trực tràng, mũi và miệng so với máu.
Virus ASF có thể được bài xuất chậm qua các đường tiêu hóa (phân), đường hô hấp (mũi miệng) tại thời điểm 2-5 ngày sau nhiễm, tương ứng với thời điểm xuất hiện các dấu hiệu lâm sàng đầu tiên. Một nghiên cứu gây bệnh khác của Oh et al. (2022) chứng minh các heo gây nhiễm chủng virus ASF có virus trong máu được phát hiện vào ngày thứ 3, và tăng dần đến ngày 9 sau gây nhiễm. Bên cạnh đó, virus ASF cũng ghi nhận hiện diện sớm trong các cơ quan phổi, gan, lách, hạch và tuyến ức (3 ngày sau gây nhiễm) và thận (5 ngày sau gây nhiễm). Các nghiên cứu khác về thời gian lây lan bệnh từ các heo được gây nhiễm cho các heo tiếp xúc trực tiếp, heo tiếp xúc gián tiếp qua vách ngăn và qua không khí khoảng cách ngắn đã được thực hiện. Những heo tiếp xúc trực tiếp với heo bệnh bắt đầu có biểu hiện lâm sàng lúc 9,9 ± 1,6 ngày sau phơi nhiễm và 8-10 ngày sau phơi nhiễm. Heo tiếp xúc với heo nhiễm bệnh với ô chuồng bên cạnh có dấu hiệu lâm sàng lúc 12,7 ± 2,0.
Bên cạnh đó, một số heo tiếp xúc gián tiếp qua không khí với ô chuồng heo bệnh bên cạnh xuất hiện lâm sàng đầu tiên lúc 11-12 ngày [9]. Việc truyền lây qua không khí của ASFV được xem là không quan trọng, mặc dù virus này có thể truyền lây qua không khí trong khoảng cách ngắn. Những nghiên cứu trên cho thấy tốc độ lây lan của ASFV trong các điều kiện thực nghiệm là chậm, có thể heo mẫn cảm cần tiếp xúc trực tiếp heo nhiễm bệnh ở thời điểm bài xuất mầm bệnh cùng lúc bộc phát lâm sàng sớm. Ở điều kiện thực địa, những phân tích về những ổ dịch trên heo nhà ở Châu Âu cũng cho thấy virus ASF lây lan khá chậm. Tỷ lệ phát hiện virus ASF bởi qPCR ở mẫu máu và mẫu dịch miệng trên heo ở các ổ dịch là 35,6 % và 22,2 %, tương ứng, với nồng độ DNA virus cũng rất thấp ở dịch miệng. Khả năng virus ASF không được bài thải sớm khi heo ủ bệnh và tỷ lệ tử vong cao là yếu tố thuận lợi về mặt dịch tễ, hạn chế tốc độ lây lan.
Khác với kết quả từ thực nghiệm gây nhiễm và diễn biến dịch ở Châu Âu, các khảo sát dịch tễ lây lan ASF ở Việt Nam cho thấy tỷ lệ nhiễm trên heo ở các ổ dịch rất cao và xảy ra nhanh chóng. Tỷ lệ mắc bệnh tích luỹ 50% ở một Trại nái hở (126 heo) vào tuần đầu tiên và ở một Trại nái kín (472 heo) là tuần thứ 3 sau khi phát dịch. Tương tự, tỷ lệ chết (50%) trên heo ở dãy chuồng kín của một trại heo nổ dịch vào ngày thứ 20 sau khi ghi nhận heo chết bệnh. Một nghiên cứu khác ghi nhận chỉ trong vòng 1 tháng bệnh xuất hiện ở một trang trại công nghiệp, tỷ lệ mắc bệnh và tử vong trên các nhóm heo là rất cao, trên nái (53,81% và 47,67%, tương ứng), trên heo thịt (90,12% và 83,33%, tương ứng), và heo cai sữa (84,37% và 79,49%, tương ứng). Nghiên cứu của Lai et al. (2022) xác định rằng tỷ lệ nhiễm ASF trên các heo khảo sát ở trại hở cao hơn trại kín (p<0,05). Heo nái tiếp xúc trực tiếp với heo bệnh (nằm bên cạnh) có tỷ lệ nhiễm cao hơn (p<0,001) so với heo tiếp xúc gián tiếp gần và tiếp xúc gián tiếp xa. Sự khác nhau về tỷ lệ lây nhiễm ASF giữa kết quả từ các thí nghiệm gây bệnh và thực tế ổ dịch có thể đến từ nhiều nguyên nhân làm thay đổi đặc trưng dịch tễ và khả năng phát tán của virus, là chủ đề quan trọng cần được lược duyệt và thảo luận để làm nền tảng cho chiến lược đối phó và phòng bệnh; trong đó yếu tố con người được xem là yếu tố truyền lây chính.
Chỉ trong vòng 7 tháng, ASF đã nhanh chóng xuất hiện trên tất cả 63 tỉnh (thành phố) của Việt Nam. Vai trò của hệ sinh thái chăn nuôi, thực trạng chuỗi thực phẩm thịt heo và hoạt động của con người trong bối cảnh dịch tễ của Việt Nam được đánh giá trong nhiều nghiên cứu. Phần lớn nông dân nắm bắt thông tin tình hình dịch bệnh tại địa phương rất chậm trước thực trạng bệnh lưu hành tại địa phương. Việc hiểu biết về dịch tả heo châu Phi ảnh hưởng rất nhiều đến công tác phòng bệnh, ứng phó và xử lý đàn heo bệnh của từng nông hộ. Các hộ chăn nuôi có kiến thức tốt về dịch bệnh có xu hướng thực hiện nhiều biện pháp phòng dịch tốt hơn. Các chủ trại heo quy mô nhỏ ở Việt Nam có xu hướng tò mò xem heo bệnh ASF ra sao hoặc tham gia tiêu hủy heo bệnh, từ đó tiếp xúc mang virus ASF ngược về trại của gia đình mình. Một số nghiên cứu khác đã báo cáo rằng các vật dụng chăn nuôi, các chất thải từ chăn nuôi (nước thải, thức ăn thừa) và côn trùng thuộc trại heo mắc dịch có chứa nhiều virus ASF.
Ở khía cạnh khác, nhiều biện pháp tiêu hủy heo mắc ASF như đốt hủy, đốt chôn hoặc chôn lấp đã được hướng dẫn chi tiết; tuy nhiên, thực tế ở các thời điểm dịch lan rộng sự quá tải về khả năng thực hiện nên rất nhiều trường hợp xác heo không được tiêu hủy đúng cách. Mầm bệnh có cơ hội phát tán ra rộng môi trường và lây lan gián tiếp qua các vật chủ trung gian như chó, mèo, chim hoang, gặm nhấm và côn trùng. Nồng độ H2S tại các điểm chôn lấp và mật độ Coliform trong nước mặt cạnh hố chôn và trong nước ngầm cao gấp nhiều lần quy chuẩn cho phép. Thêm vào đó, các trại heo sử dụng nước mặt (sông, suối) chưa qua khử trùng cũng mang nguy cơ cao vấy nhiễm virus ASF. Tỷ lệ mắc ASF biến động theo mùa ở miền Bắc được báo cáo qua một khảo sát, cao nhất là mùa hè có lượng mưa cao.
Quy mô chăn nuôi cũng cần được xem xét là một yếu tố quan trọng trong việc lây lan của ASF ở Việt Nam. Tỷ lệ bệnh xảy ra chủ yếu ở những nông hộ, trại heo nhỏ có sự hiểu biết kỹ thuật hạn chế, cơ sở hạ tầng chăn nuôi kém và khả năng phòng chống bệnh thấp. Các trại chăn nuôi quy mô nhỏ, gia đình và nông hộ thường tận dụng thức ăn thừa trong nhà, thu gom từ nhà hàng, hoặc các nơi bán thực phẩm để làm thức ăn cho heo, đây chính các nguồn có khả năng chứa virus ASF.
Trại quy mô vừa và lớn thực hiện các biện pháp phòng bệnh tốt hơn có tỷ lệ bệnh và heo chết do ASF thấp hơn. Những trại nuôi heo nái sử dụng máng ăn-uống chung có nguy cơ và tỷ lệ lây nhiễm bệnh cao hơn so với các trại nuôi heo nái sử dụng máng ăn-uống cá thể. Việc sử dụng hệ thống máng ăn-uống chung ở trại heo nái, có thể là yếu tố thúc đẩy tốc độ lây lan nhanh khi virus ASF xâm nhập vào vì virus này được xem là có con đường lây chính qua tiếp xúc và tiêu hóa. Mổ khám heo bệnh và di chuyển heo bệnh đến vị trí khác của trại có thể làm vấy nhiễm mầm bệnh rộng và xa hơn.
Những trại chăn nuôi gần chợ buôn bán động vật có nguy cơ mắc ASF cao hơn so với những trại cách chợ >1 km. Bên cạnh đó, trại có khoảng cách gần đường giao thông chính có nguy cơ mắc ASF cao hơn, có thể do virus ASF vấy nhiễm ra ngoài môi trường qua hoạt động vận chuyển heo bệnh, tắm heo dọc đường hoặc các sản phẩm thịt nhiễm bệnh. Trại tách rời nhà ở và khu vực sinh hoạt của con người cũng có tỷ lệ xảy ra dịch ASF thấp hơn. Vấn đề truyền lây virus ASF quan trọng qua thức ăn chăn nuôi và chuỗi thực phẩm chưa được khảo sát đầy đủ, nhất là thực trạng hiện diện của virus ASF trong chuỗi thực phẩm thịt heo và sự vấy nhiễm theo vectors chính yếu mang mầm bệnh trở lại trại heo ra sao. Ngoài ra, đã có báo cáo về các ca bệnh ASF trên heo rừng tại Việt Nam, tuy nhiên vai trò đầy đủ của quần thể heo rừng, heo rừng lai nuôi theo mô hình trại trong vòng truyền lây ASF trong bối cảnh dịch tễ ở nước ta chưa được khảo sát đầy đủ.
CÁC BIỆN PHÁP ĐỐI PHÓ, KIỂM SOÁT VÀ PHÒNG BỆNH
Trước bối cảnh dịch tễ ASF phức tạp đang diễn ra, nhiều giải pháp được đưa ra từ cấp chính phủ, địa phương, chuyên gia, nhà khoa học và cả từ sự chủ động của các trại chăn nuôi heo bao gồm phát triển vaccine phòng bệnh, xây dựng trại heo mới ở vùng chưa xuất hiện dịch, cải tiến cơ sở hạ tầng trại heo theo hướng kín an toàn hơn, nâng cao áp dụng các giải pháp an toàn sinh học và sử dụng nhiều loại chế phẩm thuốc, chất bổ sung có tính năng ức chế virus. Thực tế, cũng không nhỏ số trại chăn nuôi thu gom những heo sống sót qua ổ dịch để làm heo giống trong tái đàn heo. Nhìn chung, chiến lược phòng bệnh bệnh nguy hiểm như ASF cần được xem xét ở hai lựa chọn chiến lược là Thiết lập vùng chăn nuôi an toàn dịch bệnh (free disease zone) hoặc Chấp nhận vùng chăn nuôi có sự lưu hành mầm bệnh (endemic).
Việt Nam có thể trở thành một trong số ít quốc gia đầu tiên cho phép thông hành một loại vaccine sống nhược độc, được sản xuất trong nước, để phòng bệnh ASF đang diễn biến phức tạp hiện nay với mục tiêu nhằm đảm bảo nhu cầu quan trọng về nguồn thực phẩm thịt heo. Các thử nghiệm chủng vaccine ASFV-G-ΔI177L và ASFV-G-ΔMGF, nhận chuyển giao Masterseed từ nước ngoài đang được tiến hành nhằm đánh giá hiệu quả và an toàn. Trong ngắn hạn, vaccine ASF thương mại đảm bảo an toàn và hiệu quả cần có thêm thời gian để tiếp tục thử nghiệm, nghiên cứu tối ưu quy chuẩn sản xuất đại trà. Do đó, các biện pháp an toàn sinh học vẫn là một chìa khóa quan trọng trong phòng chống ASF.
Thực tế cho thấy, các trại heo hiện đại có đủ điều kiện đảm bảo về vị trí địa lý, cơ sở vật chất, con người được đào tạo cùng quy trình thực hành chăn nuôi tốt có thể đảm bảo an toàn sinh học; trong khi ngược lại thì trại heo khác có thể bị xâm nhiễm ASF bất kỳ lúc nào khi nằm trong vùng nguy cơ cao. Một số chế phẩm sinh học đã được chứng minh có khả năng ức chế các chủng ASFV thực địa, và được sử dụng bởi người chăn nuôi của vùng chịc tác động của dịch bệnh. Nồng độ Silver nanoparticles (SNPs) ở nồng độ thử nghiệm thấp (0.78 ppm) có tác dụng ức chế hoàn toàn ASFV ở nồng độ 103 HAD50. Natural Oil Blend Formulation (NOBF) cũng được báo cáo có tác dụng ức chế virus ASF ở cả điều kiện in vitro và in vivo. Thêm vào đó, các acid béo mạch trung bình và dung dịch RME kháng khuẩn cũng được xác định có khả năng ức chế virus ASF trong thức ăn khi thử nghiệm quy mô phòng thí nghiệm.
Ở vùng endemic ASF, biện pháp phản ứng nhanh là rất cần thiết trong kiểm soát bệnh như chẩn đoán nhanh, loại bỏ các heo bị nhiễm bệnh, tăng cường vệ sinh sát trùng, tách biệt heo nhạy cảm, đảm bảo an toàn hoạt động chuyển heo, xử lý thức ăn thừa và tiêu hủy heo chết khi nghi ngờ ASF [35, 36]. Chính sách buộc tiêu hủy toàn đàn heo nhiễm, phù hợp ở giai đoạn đầu nhằm chặn đứng sự lây lan của virus ra diện rộng; nhưng sẽ gặp trở ngại rất lớn về khả năng tài chính bồi thường khi tiêu hủy, thiệt hại khổng lồ cho các trại heo, vượt quá khả năng xử lý xác chết trên quy mô lớn và liên quan đến phúc lợi động vật.
Chiến lược giới hạn phạm vi “đơn vị dịch tễ” để cô lập và loại trừ heo mắc bệnh có thể là tiếp cận mới, để giảm nguy cơ và thiệt hại của ASF có tính thực tế ở các vùng nhiễm virus ASF. Tuy nhiên, hiệu quả của các biện pháp can thiệp nhằm giảm thiểu thiệt hại do ASF lây lan phụ thuộc nhiều vào thời gian và tốc độ thực hiện. Các biện pháp an toàn sinh học được thực hiện trong vòng 14 ngày kể từ khi dịch bệnh bùng phát có thể ngăn chặn tới 74% số heo chết, và với thực hành an toàn sinh học không đầy đủ có thể dẫn đến sự tồn tại dai dẳng của ASF. Ở nước ta, tình trạng endemic ASF ở diện rộng phạm vi toàn quốc thì song hành với giải pháp an toàn sinh học nghiêm ngặt cho trại chưa xảy ra dịch bệnh thì kịch bản xử lý ổ dịch và tái đàn sau nhiễm ASF cũng cần được khuyến cáo áp dụng, mang lại hiệu quả tạm thời bảo vệ ổn định đàn heo cho đến khi một giải pháp hoàn hảo hơn được thay thế trong tương lai.
Khi ASFV xâm nhiễm vào trang trại, kịch bản xử lý ổ dịch cần khởi động là phát hiện sớm heo nhiễm, đây là chìa khóa mang lại hiệu quả của kiểm soát dịch bệnh. Các dấu hiệu lâm sàng bất thường xuất hiện ở một số ca bệnh đầu tiên là bỏ ăn, ủ rũ, đỏ da, tím tái ở các vùng da mỏng [13, 40, 41], và các dấu hiệu không thường xuyên như nôn mửa, tiêu chảy (đôi khi có máu) khi quan sát ca bệnh ở các trại heo. Các ca bệnh đầu tiên không được phát hiện sớm trong một tuần đầu, mầm bệnh đã bài thải từ heo bệnh ra ngoài sẽ làm cho sự lây lan phức tạp hơn trong trại.
Sự cô lập, cách ly tạm thời thú nghi ngờ bệnh, ủ bệnh và tăng cường khử trùng các khu vực xung quanh giảm thiểu hữu hiệu sự tồn tại, vấy nhiễm mầm bệnh ra môi trường. ASFV là virus có kích thước lớn và có vỏ bọc nên dễ bị bất hoạt bởi một số loại thuốc khử trùng thông thường, such as 1% formaldehyde, sodium hypochlorite (0.03-0.0075%), glutaraldehyde-formic và nhiều loại thuốc khử trùng tổng hợp khác. Ở trại bị virus ASF xâm nhập, các hoạt động mổ khám và di chuyển heo không được khuyến cáo do là con đường gieo rắc mầm bệnh cho heo bên cạnh, chuồng bên cạnh hay ra ngoài môi trường xung quanh.
Xét nghiệm heo có lâm sàng khẩn cấp trong 24 giờ, 2 heo tiếp xúc trực tiếp bên cạnh và các heo tiếp xúc gián tiếp nhằm đảm bảo phát hiện sớm heo ủ bệnh để loại trừ ngay nguồn bệnh, hạn chế tối đa sự bài thải mầm bệnh xảy ra. Sau đó, tiếp tục giám sát lâm sàng và xét nghiệm các heo nghi ngờ khác lúc 3, 5, 7 ngày và sau một vài tuần; thêm vào đó các heo chết hoặc bệnh có trong trại cần được xét nghiệm và loại bỏ khỏi đàn. Khẩn cấp xử lý ca dương tính ASF đầu tiên qua phong tỏa khu chuồng để xử lý nguồn bệnh, vectors trung gian và khử trùng sâu môi trường xung quanh. Ưu tiên cô lập heo bệnh, heo tiếp xúc và khử trùng khu vực có phạm vi đủ rộng đảm bảo mầm bệnh không phát tán ra xung quanh. Loại trừ heo nhiễm “tooth extraction” qua sử dụng qPCR xét nghiệm nhanh heo mang mầm bệnh ASF.
Khi trong một ô chuồng heo thịt có heo nhiễm, sẽ loại ô chuồng đó và các ô chuồng tiếp xúc gần nhất ở 4 hướng (trước, sau, trái và phải) thay vì hủy cả trại. Biện pháp này đã được áp dụng có hiệu quả tại Trung Quốc và ghi nhận số lượng heo tiêu hủy giảm đáng kể. Đặc biệt, các trại chăn nuôi heo có sự hiện diện nhiều động vật hoang như chim, chuột và côn trùng (ruồi, muỗi) có tỷ lệ bệnh ASF cao hơn, có thể là con đường lây cơ học. Virus ASF có thể theo vector này để lây lan bệnh, đặc biệt loài ruồi chuồng trại Stomoxys calcitrans. Toàn trại cần được cảnh báo để tạm dừng các hoạt động không cần thiết nhằm kiểm soát sự lây nhiễm bên trong và ngoài, nhất là hoạt động mổ khám, tiêm chích, thăm quan, mua bán. Các hoạt động có thể được bổ sung gồm xét nghiệm tầm soát diện rộng hơn ở các dãy chuồng, đối tượng có nguy cơ bị lây nhiễm, đảm bảo mầm bệnh không hiện diện ở môi trường nuôi, trên heo, và công nhân chăn nuôi bởi do khả năng sống sót lâu dài của mầm bệnh này. Kiểm dịch thú y nghiêm ngặt trên tất cả các đối tượng nguy cơ mang mầm bệnh, để phát hiện, và xử lý kịp thời. Việc xử lý có thể loại trừ virus ASF ra khỏi trại trong ngắn hạn, nhưng dài hạn thì cần đổi mới thực hành an toàn sinh sinh học: tái thiết khu vực chăn nuôi, tái sắp xếp hoạt động chăn nuôi của trại theo hướng an toàn, chặt chẽ hơn.
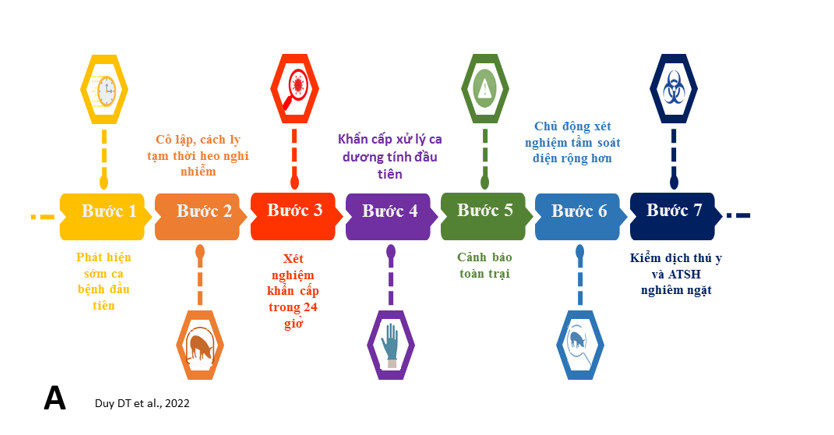
Hình A. Các bước xử lý khẩn cấp, giới hạn sự lây truyền mầm bệnh ở trại heo. Một tuần là thời gian vàng để tầm soát nhanh và loại trừ heo nhiễm ra khỏi trại
Thời kì hậu ASF, tái đàn có vai trò thiết yếu để phục hồi đàn heo. Có hai khuynh hướng thực hành tái đàn là xây dựng trại heo mới ở vùng chưa xuất hiện dịch với sự đầu tư, quy mô, và mức độ an toàn sinh học cao; hoặc tái đàn từ trại heo đã xảy ra dịch ASF qua việc cải tiến cơ sở hạ tầng trại heo theo hướng kín an toàn hơn, nâng cao áp dụng các giải pháp an toàn sinh học. Ở vùng chăn nuôi có tình trạng ASF endemic thì nguy cơ mầm bệnh xâm nhập vào trại heo được tái đàn là rất cao, ngược lại trại heo nằm ở vùng an toàn dịch sẽ có sự an toàn hơn. Ở trại heo mắc bệnh, loại đàn là biện pháp loại bỏ nguồn bệnh và giảm thiểu nguy cơ bài thải mầm bệnh ra ngoài chuồng nuôi và môi trường xung quanh.
Các hoạt động mổ khám heo bệnh hoặc nghi mắc bệnh nên bị cấm vì có thể dẫn đến vấy nhiễm trên diện rộng. Loại đàn đồng loạt là bước khởi đầu cho quyết định tái đàn sau này, thời gian chấm dứt ca bệnh sau cùng ở trại heo mắc bệnh là thời điểm không còn nguồn bệnh. Vệ sinh khử trùng sâu và toàn diện sẽ giúp bất hoạt toàn bộ virus tồn tại trong và ngoài khu vực chuồng nuôi. Vệ sinh khử trùng sâu có thể được thực hiện theo các bước: i) Loại bỏ các vật dụng, dụng cụ và quần áo vấy nhiễm sau khi loại đàn; ii) Làm sạch cơ học các chất thải trong trại nuôi và tiến hành khử trùng toàn bộ chuồng nuôi và vật dụng chăn nuôi; iii) Bất hoạt và cắt đứt các con đường lây lan mầm bệnh từ bên ngoài chuồng nuôi [50]. Sau giai đoạn hoàn tất vệ sinh khử trùng, việc để trống chuồng nuôi một khoảng thời gian có ý nghĩa quan trọng giảm sự tồn tại của virus, thời gian càng dài sự sống của virus càng thấp.
Việc kiểm tra sự an toàn của chuồng nuôi không còn vấy nhiễm mầm bệnh là cột mốc quan trọng để khởi động thả heo giống vào chuồng, thường qua 2 cách như xét nghiệm mẫu môi trường và nuôi thử heo chỉ báo (sentinel). Nuôi heo chỉ báo là cách thử nghiệm sinh học chính xác và thực tế trong việc đánh giá khả năng tồn tại và gây nhiễm heo nhạy cảm của mầm bệnh. Heo chỉ báo, khỏe mạnh được thả nuôi với số lượng khoảng 10% so với công suất nuôi của trại và được nhốt rải rác ở các ô chuồng và ở lối đi trong chuồng, hành lang. Theo dõi, giám sát chặt chẽ sức khỏe và xét nghiệm huyết thanh học heo chỉ báo trong tối thiểu 21 ngày, dài hơn đến 4-6 tuần thì tốt hơn. Ở Trung Quốc, các trại được cho phép tái đàn nếu heo chỉ báo được nuôi trong 45 ngày không ghi nhận sự bất thường và có kết quả xét nghiệm âm tính. Heo chỉ báo khỏe mạnh và âm tính là cơ sở an toàn cho bước tái đàn đầy công suất của trại. Từ thời điểm này, thực hành chăn nuôi tốt và an toàn sinh học nghiêm ngặt là then chốt để bảo vệ đàn heo trước nguy cơ xâm nhiễm cao của virus ASF từ bên ngoài.
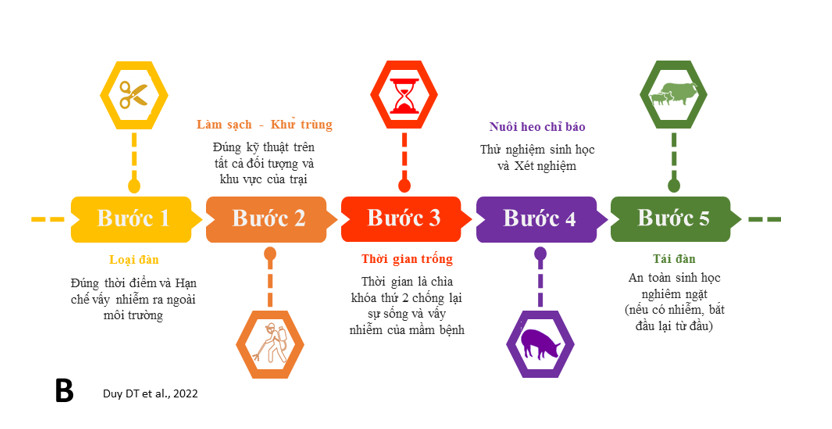
Hình B. Mô hình tái đàn 5-bước thực hiện ở trại heo khi xảy ra ổ dịch ASF
KẾT LUẬN
Sau 3 năm từ ca bệnh đầu tiên, ASF có sự chuyển biến rõ rệt từ tình trạng “epidemic sang endemic”. Sự tác động của ASF làm thiệt hại lớn nhất trong lịch sử trên đàn heo ở nước ta. Đặc điểm dịch tễ của ASF trên heo nuôi nhà ở một nước như Việt Nam là rất đặc biệt, là bài học giá trị cho các nước tương đồng về hệ sinh thái chăn nuôi, chuỗi thực phẩm thịt heo, và tập quán gắn liền sự giao thoa chăn nuôi và con người. Sự áp dụng nhanh chóng các kết quả khảo sát, nghiên cứu trên thực địa, thử nghiệm và đặc biệt thích ứng phù hợp với mô hình chăn nuôi an toàn sinh học mới là chìa khóa hữu hiệu đảm bảo sự ổn định đàn heo ở các năm sau khi đỉnh dịch qua đi. Trong dài hạn, chọn chiến lược loại trừ mầm bệnh ở các vùng chăn nuôi hay phòng bệnh bởi một giải pháp như tiêm phòng trong vùng đặc hữu bệnh là một thách thức lớn. Thay đổi tư duy và thực hiện chăn nuôi an toàn, bền vững hơn với đảm bảo an toàn sinh học cao mang lại hiệu quả phòng bệnh. Tuy nhiên, giải pháp này cần có sự đầu tư lớn, thuận lợi cho mô hình trang trại mới, hiện đại; trong khi mô hình nào đảm bảo phòng bệnh cho hộ chăn nuôi và trang trại nhỏ cần được nghiên cứu nhiều hơn.
PGS. TS. Đỗ Tiến Duy
Khoa Chăn Nuôi Thú Y, Trường Đại học Nông Lâm TP. Hồ Chí Minh
Khu phố 6, P. Linh Trung, Tp. Thủ Đức, TP. Hồ Chí Minh
Tài liệu tham khảo
1. Pejsak, Z., et al., Epidemiology of African swine fever in Poland since the detection of the first case. Polish journal of veterinary sciences, 2014. 17(4).
2. Bui, N. Vietnam African Swine Fever Update. 2021; Available from: https://apps.fas.usda.gov/newgainapi/api/Report/DownloadReportByFileName?fileName=Vietnam%20African%20Swine%20Fever%20Update_Hanoi_Vietnam_05-08-2021.pdf.
3. Le, V.P., et al., Outbreak of African swine fever, Vietnam, 2019. Emerging infectious diseases, 2019. 25(7): p. 1433.
4. Mighell, E. and M.P. Ward, African swine fever spread across Asia, 2018–2019. Transboundary and Emerging Diseases, 2021. 68(5): p. 2722-2732.
5. Que, N.N., et al., Economic impacts of African swine fever in Vietnam. ILRI Research Brief 99. Nairobi, Kenya: ILRI, 2020.
6. Lee, H.S., et al., Pathogenicity of an African swine fever virus strain isolated in Vietnam and alternative diagnostic specimens for early detection of viral infection. Porcine health management, 2021. 7(1): p. 1-11.
7. Oh, T., et al., Chronological expression and distribution of African swine fever virus p30 and p72 proteins in experimentally infected pigs. Scientifc Reports, 2022. 12(1): p. 4151.
8. Guinat, C., et al., Dynamics of African swine fever virus shedding and excretion in domestic pigs infected by intramuscular inoculation and contact transmission. Veterinary research, 2014. 45(1): p. 1-9.
9. Olesen, A.S., et al., Transmission of African swine fever virus from infected pigs by direct contact and aerosol routes. Veterinary microbiology, 2017. 211: p. 92-102.
10. Olesen, A.S., et al., Potential routes for indirect transmission of African swine fever virus into domestic pig herds. Transboundary and Emerging Diseases, 2020. 67(4): p. 1472-1484.
11. Chenais, E., et al., Epidemiological considerations on African swine fever in Europe 2014–2018. Porcine health management, 2019. 5(1): p. 1-10.
12. Lai, C.D., et al., Transmission characteristics of African swine fever virus genotype-II in the field outbreaks. Journal of veterinary science and technology, in press 2022.
13. Nguyen, C.T., et al., Some features of African swine fever through investigation on disease progression in the field outbreaks. Journal of veterinary science and technology, 2021. XXVIII(2): p. 21-29.
14. Oh, T., et al., Long‐term follow‐up of convalescent pigs and their offspring after an outbreak of acute African swine fever in Vietnam. Transboundary and Emerging Diseases, 2021. 68(6): p. 3194-3199.
15. Woonwong, Y., T.D. Do, and R. Thanawongnuwech, The future of the pig industry after the introduction of African swine fever into Asia. Animal Frontiers, 2020. 10(4): p. 30-37.
16. Tran, T.D., Effects of the African Swine Fever on Farmers’ Livestock Activities in Long My District, Hau Giang Province. Vietnam Journal of Agricultural Sciences, 2020. 18(10): p. 828-838.
17. Hoang, H.A. and N. Le, Factors influencing preventative measures against African swine fever of farming households in Dong Nai province. Can Tho University Journal of Science, 2021. 57(4): p. 267-277.
18. Vo, T.Q., et al., Epidemiological characteristics and risk factors related to African swine fever at household farm level in Cho Gao district of Tien Giang province. Journal of veterinary science and technology, 2021. XXVIII(3): p. 20-27.
19. MARD, Technical guidelines for compulsory destruction of sick pigs and their products. 2018.
20. MARD, Measures to treat and destroy pigs infected with African swine fever by burning method. 2019.
21. Vo, H.C., et al., Environmental situations of African swine fever carcass disposal landfills in Thai Binh province. TNU Journal of Science and Technology, 2021. 226(14): p. 37-44.
22. Phan, T.H.P., et al., Study on the situation of African swine fever disease in Quang Ninh province. Journal of veterinary science and technology, 2020. XXVII(5): p. 12-19.
23. Tran, T.H., et al., Study on some Epidemiological Characteristics of African Swine Fever in Quynh Phu District, Thai Binh Province. Vietnam Journal of Agricultural Sciences, 2021. 19(11): p. 1436-1445.
24. Nguyen, D.H., et al., Epidemiolpgy of African swine fever in Can Tho city – Preliminary study. Journal of veterinary science and technology, 2020. XXVII(7): p. 5-15.
25. Truong, V.H., et al., Investigation on the risk factors and prevalence of African swine fever virus (ASFV) in Ben Tre province. Journal of veterinary science and technology, 2020. XXVII(3): p. 5-12.
26. Nguyen, T.D.N., et al., Swine Production and Challenges in Vietnam after African Swine Fever: A Case Study in Peri-Urban Hanoi, Vietnam. Vietnam Journal of Agricultural Sciences, 2021. 4(1): p. 965-977.
27. Denstedt, E., et al., Detection of African swine fever virus in free‐ranging wild boar in Southeast Asia. Transboundary and Emerging Diseases, 2021. 68(5): p. 2669-2675.
28. Tran, X.H., et al., African swine fever virus vaccine candidate ASFV‐G‐ΔI177L efficiently protects European and native pig breeds against circulating Vietnamese field strain. Transboundary and Emerging Diseases, 2021.
29. Dung, T.T.N., et al., Silver nanoparticles as potential antiviral agents against African swine fever virus. Materials Research Express, 2020. 6(12): p. 1250g9.
30. Truong, Q.L., et al., Natural oil blend formulation as an anti-African swine fever virus agent in in vitro primary porcine alveolar macrophage culture. Veterinary World, 2021. 14(3): p. 794.
31. Tran, H.T.T., et al., The potential anti-African swine fever virus effects of medium chain fatty acids on in vitro feed model: An evaluation study using epidemic ASFV strain circulating in Vietnam. Open Veterinary Journal, 2021. 11(3): p. 346-355.
32. Tran, H.T.T., et al., Genetic characterisation of African swine fever virus in outbreaks in Ha Nam province, Red River Delta Region of Vietnam, and activity of antimicrobial products against virus infection in contaminated feed. Journal of veterinary research, 2020. 64(2): p. 207-213.
33. Barongo, M.B., et al., A mathematical model that simulates control options for African swine fever virus (ASFV). PloS one, 2016. 11(7): p. e0158658.
34. Blome, S., K. Franzke, and M. Beer, African swine fever–A review of current knowledge. Virus research, 2020. 287: p. 198099.
35. Costard, S., et al., Partitioning, a Novel Approach to Mitigate the Risk and Impact of African Swine Fever in Affected Areas. Frontiers in Veterinary Science, 2022. 8.
36. Nantima, N., et al., Enhancing knowledge and awareness of biosecurity practices for control of African swine fever among smallholder pig farmers in four districts along the Kenya–Uganda border. Tropical animal health and production, 2016. 48(4): p. 727-734.
37. Busch, F., et al., Evidence-based African swine fever policies: Do we address virus and host adequately? Frontiers in veterinary science, 2021. 8: p. 224.
38. OIE, African swine fever (Infection with Africa swine fever virus), in OIE terrestrial manual 2019. Chapter 3.8.1. 2019: Paris: World organization for animal health.
39. Pham, T.N.H., et al., Surveillance on clinical symptoms and diagnosing African swine fever (ASF) in some provinces of the Mekong Delta. Journal of veterinary science and technology, 2021. XXVIII(1): p. 5-11.
40. Juszkiewicz, M., M. Walczak, and G. Woźniakowski, Characteristics of selected active substances used in disinfectants and their virucidal activity against ASFV. Journal of veterinary research, 2019. 63(1): p. 17.
41. Gavier-Widén, D., et al., African swine fever in wild boar in Europe: a notable challenge. Vet Rec, 2015. 176(8): p. 199-200.
42. Linan, W. Direct from China: A Look at ASF Biosecurity Changes, Testing and Vaccine Development. 2020 [cited February 08, 2022]; Available from: https://www.thepigsite.com/articles/direct-from-china-a-look-at-asf-biosecurity-changes-testing-and-vaccine-development.
43. Dominique, P. Analysis: African swine fever inflicts renewed toll on northern China’s hog herd. 2021 [cited March 12, 2022]; Available from: https://www.reuters.com/business/healthcare-pharmaceuticals/african-swine-fever-inflicts-renewed-toll-northern-chinas-hog-herd.
44. EFSA, et al., Research priorities to fill knowledge gaps in the control of African swine fever: possible transmission of African swine fever virus by vectors. EFSA Journal, 2021. 19(6): p. e06676.
45. Vergne, T., et al., Mechanical transmission of African swine fever virus by Stomoxys calcitrans: Insights from a mechanistic model. Transboundary and emerging diseases, 2021. 68(3): p. 1541-1549.
46. de Carvalho Ferreira, H., et al., African swine fever virus excretion patterns in persistently infected animals: a quantitative approach. Veterinary microbiology, 2012. 160(3-4): p. 327-340.
47. Spickler, A.R. African Swine Fever. 2019 [cited March 08, 2022]; Available from: http://www.cfsph.iastate.edu/DiseaseInfo/factsheets.php.
50 . De Lorenzi, G., et al., African swine fever: A review of cleaning and disinfection procedures in commercial pig holdings. Research in Veterinary Science, 2020. 132: p. 262-267.
- Gia Lai: Thu hút nhiều dự án chăn nuôi heo ngay từ đầu năm
- Kỷ Nguyên Xanh, Olmix Asialand Việt Nam và VMC Việt Nam ký Biên bản ghi nhớ hợp tác phát triển chuỗi giá trị chăn nuôi
- Dự án ZOLA: Chủ động phòng ngừa bệnh truyền lây từ chợ động vật sống theo cách tiếp cận Một Sức khỏe
- Đà Nẵng siết chặt phòng, chống bệnh dại, yêu cầu nâng tỷ lệ tiêm phòng chó mèo
- Ứng dụng khoa học và công nghệ nâng cao giá trị thương hiệu “Gà nhiều cựa Tân Sơn”
- Chăn nuôi heo khởi sắc đầu năm 2026, ngành chăn nuôi vẫn thận trọng trước nguy cơ dịch bệnh
- Olmix Asialand Việt Nam tuyển dụng Kỹ thuật Thị trường (Thuốc & Vaccine Thú y) khu vực miền Bắc
- Trung Quốc kêu gọi giảm sản lượng heo để hạ nhiệt tình trạng dư cung
- ELT Science – Tiên phong chăm sóc sức khỏe thú cưng
- Nuôi dế cùng chim cút, sự kết hợp hoàn hảo
Tin mới nhất
T2,09/03/2026
- Gia Lai: Thu hút nhiều dự án chăn nuôi heo ngay từ đầu năm
- Kỷ Nguyên Xanh, Olmix Asialand Việt Nam và VMC Việt Nam ký Biên bản ghi nhớ hợp tác phát triển chuỗi giá trị chăn nuôi
- Dự án ZOLA: Chủ động phòng ngừa bệnh truyền lây từ chợ động vật sống theo cách tiếp cận Một Sức khỏe
- Nhiều doanh nghiệp sản xuất thức ăn chăn nuôi đồng loạt tăng giá từ tháng 3/2026
- Đà Nẵng siết chặt phòng, chống bệnh dại, yêu cầu nâng tỷ lệ tiêm phòng chó mèo
- Ứng dụng khoa học và công nghệ nâng cao giá trị thương hiệu “Gà nhiều cựa Tân Sơn”
- Chăn nuôi heo khởi sắc đầu năm 2026, ngành chăn nuôi vẫn thận trọng trước nguy cơ dịch bệnh
- Olmix Asialand Việt Nam tuyển dụng Kỹ thuật Thị trường (Thuốc & Vaccine Thú y) khu vực miền Bắc
- Giá heo hơi hôm nay 6-3: Giảm giá diện rộng trên cả nước
- Trung Quốc kêu gọi giảm sản lượng heo để hạ nhiệt tình trạng dư cung
- AChaupharm: Nấm phổi gia cầm, hiểm họa thầm lặng khi giao mùa
- Chuyên gia bàn giải pháp sử dụng kháng sinh có kiểm soát trong chăn nuôi
- Ngành sữa Việt Nam: Cơ hội “bứt phá” từ nội lực
- Dịch tả heo châu Phi: Hiện trạng và giải pháp kiểm soát hiệu quả (Phần 1)
- Bộ NN&MT mở đợt ‘truy quét’ việc lạm dụng chất kích tăng trưởng, tăng trọng
- Cargill rút khỏi ngành thức ăn thủy sản tại Việt Nam, đóng cửa nhà máy tại Đồng Tháp và Long An
- Chăn nuôi dê bền vững theo chuỗi giá trị: Chủ nhà hàng là mắt xích quan trọng
- Da khỏe, lông đẹp: Chiến lược dinh dưỡng hiệu quả cho heo con sau cai sữa
- Lo ngại bệnh than, Campuchia ngừng nhập một số sản phẩm từ Thái Lan
- Cạn tiền, một công ty tại Nam Phi phải tiêu hủy hơn 350.000 con gà


























































































 đã long trọng tổ chức Hội nghị tổng kết và tri ân khách hàng với chủ đề “Đồng hành dẫn lối tương lai”. Nhân dịp này, Ban Giám đốc công ty đã […]/0.jpg)











Bình luận mới nhất